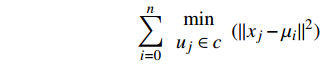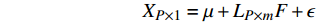Distribution patterns of biogenic components in surface sediments of the Ross Sea and their environmental implications
-
摘要: 罗斯海陆架是南极边缘海初级生产力最高的区域,是研究冰–海–气相互作用和碳循环的热点区域。 本文分析了中国第31–35次南极科考在罗斯海陆架区域采集的43个表层沉积物中的生源组分生物硅(Opal)、碳酸钙、总有机碳(TOC)、总氮(TN)含量和有机碳δ13C(δ13Corg)等指标,通过对这些指标聚类分析和因子分析,并与环境参数对比,研究了罗斯海生源要素的空间分布规律及其对环境的指示意义。结果显示,在罗斯海陆架区域内,TOC、TN、Opal是因子1的主要变量,代表水体生产力。其含量在西南陆架冰间湖和东南陆架地区显示高值,在阿代尔角外陆架地区显示低值,推测主要受溶解铁浓度的影响。δ13Corg是因子2的主要变量,其含量在特拉诺瓦湾冰间湖以及东北外陆架地区较高,在盆地海槽地区较低。δ13Corg的重值分布与生产力勃发有关,轻值分布与陆源有机碳的输入有关。碳酸钙是因子3的主要变量,含量在阿代尔角以及罗斯海冰间湖较高,在盆地海槽以及东部陆架地区较低,其含量主要受到保存效率的影响。Abstract: The Ross Sea shelf is characterized by its highest primary productivity among the Antarctic marginal seas, and is a hotspot for studying ice-ocean-atmosphere interactions and carbon cycle. This study analyzed the contents of biogenic components such as biogenic silica (Opal), carbonate, total organic carbon (TOC), total nitrogen (TN), and organic carbon δ13C (δ13Corg) in 43 surface sediments collected during the 31st-35th Chinese Antarctic Research Expeditions on the Ross Sea shelf. Cluster analysis and factor analysis were performed on the resulted data in order to obtain their distribution patterns in relation to the environmental settings. Our results show that TOC, TN and Opal are the main variables for factor 1 representing the productivity of the water column. Their contents show high values in the polynyas on the southwest shelf, and on the southeast inner shelf, in contrast to low values in the Cape Adare and outer shelf, interpreted as related to concentrations of dissolved iron in the water. δ13Corg is the main variable for factor 2, with higher values in the Terra Nova Bay polynyas and the outer northeast shelf, and lower values in the troughs. The heavier δ13Corg is resulted from high primary productivity while the lighter δ13Corg mainly reflects terrestrial carbon accumulation from lateral transport. Carbonate is the main variable for factor 3 showing higher contents at Cape Adare and in the Ross Sea polynyas, and lower contents in the troughs and the south-eastern shelf, primarily related to its preservation.
-
Keywords:
- Ross Sea /
- surface sediments /
- biogenic parameters /
- seawater surface productivity
-
南大洋表层生产力受到铁肥限制,是全球大洋高硝酸盐低叶绿素(High Nitrate Low Chlorophyll, HNLC)区域,影响浮游生物的生长和生物泵的效率[1]。罗斯海是南极生产力最高的边缘海,年初级生产力达83.4 Tg C[1-2],是全球大洋重要的海-气交换地区。罗斯海陆架冰间湖通过高效的生物泵和物理泵将大气CO2输送到深海[2],因此,罗斯海成为南大洋有效的碳汇区[1]。对罗斯海表层沉积物生产力指标的分析可以获得罗斯海海洋环境(洋流、水团、海冰等)是如何控制其生产力的变化,从而对罗斯海在碳循环中的作用有更准确的认识。
前人研究发现,罗斯海陆架生产力的分布与冰间湖有关[1,3]。在南极横贯山脉产生的下降风的作用下,冰间湖在罗斯陆架西侧形成,冰间湖的开阔水域使得藻类生物勃发[4],浮游藻类产生的有机质约0.5%在沉积物中埋藏[5]。硅藻是南大洋高纬区域主要的初级生产力,其硅质壳体的埋藏成为沉积物重要组成部分[3]。表层沉积物中有机碳δ13Corg值取决于上层海水颗粒有机碳及异地搬运有机碳的混合,典型的海源有机碳δ13C值为−22‰~−19‰,而陆源C3植物的δ13C值为−31‰~−22‰[6]。总有机碳和总氮TOC/TN的比值也可指示物源:来自海洋藻类有机质的TOC/TN比值通常为3~8,而陆生植物的TOC/TN比值通常为20甚至更高[7-8]。沉积物中碳酸钙的含量主要受到钙质壳体生物生产力以及碳酸钙保存效率的影响。前人研究显示,在南极半岛、罗斯海沉积物中碳酸钙含量较低,而在阿蒙德森海、别林斯高晋海和威德尔海,沉积物中含有相对高含量的碳酸钙[9]。
本文利用中国第31–35次南极科考在罗斯海陆架区域采取的表层沉积物样品进行TOC、TN、生物硅、碳酸钙及δ13Corg的分析,详细描绘了罗斯海表层沉积物生源组分的分布。将获得的数据采用因子分析、K-means聚类分析等数理统计方法,结合水文和地形分布特征,分析了生产力指标的环境控制因素,为罗斯海的生物地球化学过程与碳循环研究提供科学依据。
1. 区域概况
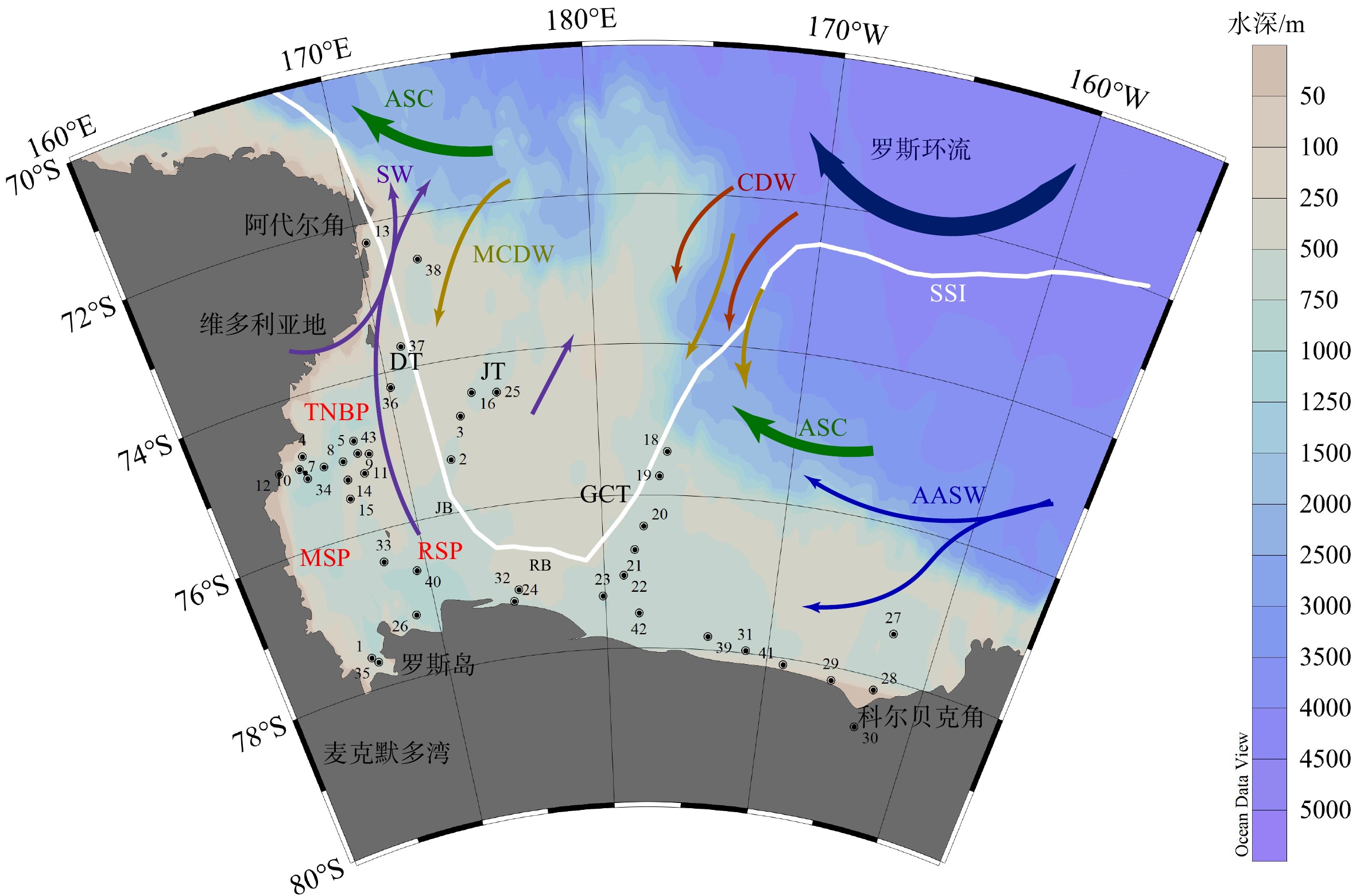
罗斯海位于南大洋太平洋扇区西南极大陆边缘,位于阿代尔角与科尔贝克角之间近三角形的区域(图1),其西部毗邻南极横贯山脉和维多利亚地,是下降风的产生地。下降风导致罗斯冰架西部和中部地区持续的北向气流[7]。海冰被这些气流驱赶,在冰架前缘形成冰间湖,例如罗斯海冰间湖(Ross Sea Polynya, RSP)、麦克默多湾冰间湖(McMurdo Sound Polynya, MSP)和特拉诺瓦湾冰间湖(Terra Nova Bay Polynya, TNBP)(图1)[10]。罗斯海陆架现代生产力分布呈现区域性特征[11-13]。区域一为170ºE以西,从罗斯冰架向北延伸到74.5ºS的西南陆架地区,该区域混和层较浅,硅藻生产力高。区域二为170 ºE以东,从罗斯冰架向北延伸到74.5ºS的中央陆架区域,该区域混合层较深,生产力以定鞭藻(Phaeocystis antarctic)为主,硅藻较少。74.5°S以北为区域三,混合层深,受海冰长期覆盖的影响,生产力较低。南大洋中溶解铁离子可以促进硅藻的勃发,数值模拟研究发现罗斯海铁离子的来源主要是深部对流(60%)和海冰融水(30%)[14]。
![]() 图 1 南极罗斯海陆架区概况[2]与2002—2011年南半球夏季海冰分布范围(https://earthdata.nasa.gov)SSI:年均夏季海冰界限,AASW:南极表层水, CDW:绕极深层水, MCDW:变性绕极深层水,SW:陆架水,ASC:南极陆坡流,MSP:麦克默多湾冰间湖,RSP:罗斯海冰间湖, TNBP:特拉诺瓦湾冰间湖,DT:Drygalski海槽,JT:Joides海槽,GCT:Glomar Challenger海槽,JB:Joides海盆,RB:罗斯浅滩。Figure 1. Ross Sea physiographic and oceanographic map with site locationsAverage Summer Sea Ice (SSI) extent (2002-2011) is from https://earthdata.nasa.gov. AASW: Antarctic Surface Water, CDW: Deep Circumpolar Water, MCDW: Modified Circumpolar Deep Water, SW: Shelf Water, ASC: Antarctic Slope Current, MSP: McMurdo Sound Polynya, RSP: Ross Sea Polynya, TNBP: Terra Nova Bay Polynya, DT: Drygalski Trough, JT: Joides Trough, GCT: Glomar Challenger Trough, JB: Joides Basin, RB: Ross Bank.
图 1 南极罗斯海陆架区概况[2]与2002—2011年南半球夏季海冰分布范围(https://earthdata.nasa.gov)SSI:年均夏季海冰界限,AASW:南极表层水, CDW:绕极深层水, MCDW:变性绕极深层水,SW:陆架水,ASC:南极陆坡流,MSP:麦克默多湾冰间湖,RSP:罗斯海冰间湖, TNBP:特拉诺瓦湾冰间湖,DT:Drygalski海槽,JT:Joides海槽,GCT:Glomar Challenger海槽,JB:Joides海盆,RB:罗斯浅滩。Figure 1. Ross Sea physiographic and oceanographic map with site locationsAverage Summer Sea Ice (SSI) extent (2002-2011) is from https://earthdata.nasa.gov. AASW: Antarctic Surface Water, CDW: Deep Circumpolar Water, MCDW: Modified Circumpolar Deep Water, SW: Shelf Water, ASC: Antarctic Slope Current, MSP: McMurdo Sound Polynya, RSP: Ross Sea Polynya, TNBP: Terra Nova Bay Polynya, DT: Drygalski Trough, JT: Joides Trough, GCT: Glomar Challenger Trough, JB: Joides Basin, RB: Ross Bank.罗斯冰架大致分布在罗斯海78°S以南的区域,由东南极冰盖和西南极冰盖共同补给[15]。罗斯海扇区TNBP和RSP都是高密度陆架水的产生地[16],并且通过Drygalski海槽和Joides海槽流出至外陆架。绕极深层水上涌至陆架与南极表层水在罗斯海北部混合,形成变性绕极深层水。绕极深层水的上涌为表层水带来大量营养盐,同时为表层提供大量溶解态的铁[17],促进陆架生产力[18]。东部的阿蒙森海的冰融水由沿岸流携带进入罗斯海成为该区域南极表层水的一部分,汇入罗斯环流。南极表层水向西流经外陆架,随沿岸流至罗斯冰架东端。
罗斯海主要初级生产力属种是硅藻和定鞭藻,其必要的营养元素是硝酸盐和硅酸盐[3,13,17]。它们在南半球春季(10—12月)开始勃发,定鞭藻在南半球春季末(12月)生产力达到鼎盛,硅藻在夏季(1—3月)生产力达到鼎盛[19]。在春季勃发初期,罗斯海陆架区域表层海水硝酸盐和硅酸盐含量较高(图2 A, B, D, F)。春、夏硝酸盐浓度分布一致,由西北外陆坡向陆架逐渐降低(图2 A, B, D, F),其最低值在东部科尔贝克角附近,即罗斯冰架东部前缘。春季硅酸盐从中西部向东部逐渐降低,夏季在阿代尔角和东陆架最高。在生物生长季节罗斯海表层海水的营养盐保持过剩[1]。罗斯海西北陆架地区存在高硝酸盐低叶绿素区域,被认为是低铁离子浓度和低温抑制了浮游生物生长[20]。
![]() 图 2 罗斯海表层海水营养盐浓度分布图A,B: 1955—2012年 罗斯海春季(10—12月)硅酸盐和硝酸盐在10 m水深的浓度;C,D:1955—2012年罗斯海夏季(1—3月)硅酸盐和硝酸盐在10 m水深浓度,改编自文献[21];E: 2009年南半球春季叶绿素月平均值;F: 2010年南半球夏季叶绿素浓度值。叶绿素分布来自https://oceanwatch.pifsc.noaa.gov/erddap/griddapFigure 2. Nutrient and chlorophyll concentration in Ross sea surface waterA, B: 1955-2012 Southern Hemisphere spring (October-December) silicate and nitrate concentration at 10 m water depth; C, D: 1955-2012 Ross Sea summer (January-March) silicate, nitrate concentration at 10 m water depth; E: spring chlorophyll concentration in 2009; F: Summer chlorophyll concentration in 2010. Chlorophyll distribution are from https://oceanwatch.pifsc.noaa.gov/erddap/griddap
图 2 罗斯海表层海水营养盐浓度分布图A,B: 1955—2012年 罗斯海春季(10—12月)硅酸盐和硝酸盐在10 m水深的浓度;C,D:1955—2012年罗斯海夏季(1—3月)硅酸盐和硝酸盐在10 m水深浓度,改编自文献[21];E: 2009年南半球春季叶绿素月平均值;F: 2010年南半球夏季叶绿素浓度值。叶绿素分布来自https://oceanwatch.pifsc.noaa.gov/erddap/griddapFigure 2. Nutrient and chlorophyll concentration in Ross sea surface waterA, B: 1955-2012 Southern Hemisphere spring (October-December) silicate and nitrate concentration at 10 m water depth; C, D: 1955-2012 Ross Sea summer (January-March) silicate, nitrate concentration at 10 m water depth; E: spring chlorophyll concentration in 2009; F: Summer chlorophyll concentration in 2010. Chlorophyll distribution are from https://oceanwatch.pifsc.noaa.gov/erddap/griddap2. 材料与方法
2.1 样品
本文研究的43个表层沉积物样品由中国第31–35次南极考察在罗斯海陆架区通过箱式、多管以及柱状取样器采集(图1,表1),本项研究对表层0~10、0~5以及0~2 cm的沉积物样品进行分析,结果见表1。沉积物大部分为灰色,灰绿色砂至粉砂质软泥,含有少量灰色细砂。位于罗斯海西岸阿代尔角附近的R19站位及东岸冰架前缘的RS78站位,表层沉积物为含较多黑色细砾的灰黑色软泥,含钙质生物壳体,R1-03有较多的黑色磨圆较好的细砾石(见表1中对应序号)。
表 1 ANT31-35航次表层样信息Table 1. Information of the studied surface sediment samples retrieved from ANT 31-35 expeditions航次 站位号 位置 水深/m 取样方式 序号 ANT31 JB01 77°35′18″S, 165°34′10″E 774 箱式样 1 JB04(0~10 cm) 75°18′04″S, 172°22′21″E 510.8 箱式样 2 JB05(0~5 cm) 74°45′19″S, 173°11′17″E 496.8 箱式样 3 R02 74°47′6″S, 165°7′59″E 719.2 箱式样 4 R05(0~5 cm) 74°46′36″S, 167°46′39″E 585.6 箱式样 5 R08 75°00′11″S, 165°00′43″E 891.8 箱式样 6 R09 75°00′12″S, 165°59′53″E 1032.1 箱式样 7 R10 74°59′68″S, 167°00′07″E 636 箱式样 8 R11(0~5 cm) 74°56′57″S, 167°48′20″E 449.4 箱式样 9 R14 74°56′06″S, 164°48′17″E 901.1 箱式样 10 R17 75°13′49″S,167°54′33″E 374.4 箱式样 11 R18 74°54′46.8″S, 163°45′50′E 46 箱式样 12 R19 72°15′16″S, 170°23′40″E 516.3 箱式样 13 R16 75°15′15″S, 166°59′50″E 486.74 多管样 14 R20 75°30′16″S, 166°50′52″E 425.59 多管样 15 JB06 74°28′22″S, 173°54′24″E 567.52 重力样 16 AB18B 71°53′55″S, 128°8′42″W 3463 箱式样 17 ANT32 RB02B 75°25′24″S, 176°29′9″W 574 箱式样 18 RB03B 75°44′48″S, 176°52′11″W 610 箱式样 19 RB05B 76°24′19″S, 177°43′10″W 606 箱式样 20 RB06B 76°42′48″S, 178°14′25″W 619 箱式样 21 RB07B 77°02′59″S, 178°54′01″W 628.3 箱式样 22 RB08B 77°18′32″S, 179°51′09″E 669.7 箱式样 23 RB11B 77°16′10″S, 174°35′59″E 494.9 箱式样 24 RB16B 74°30′49″S, 175°07′18″E 478 箱式样 25 RB15C 77°12′7″S, 168°47′19″E 939.8 重力样 26 A1-05 77°23′46″S, 162°40′41″W 658.3 箱式样 27 ANT33 A1-07 78°10′5″S, 163°2′20″W 678.8 箱式样 28 A1-08 78°10′19″S, 165°47′17″W 497.6 箱式样 29 RS78 78°41′38″S, 163°40′1″W 331.06 箱式样 30 A1-10 77°58′5″S, 171°22′23″W 514.9 箱式样 31 A1-15 77°7′37″S, 174°57′50″E 399.9 箱式样 32 A1-18 76°25′16″S, 167°43′26″E 742.8 箱式样 33 I5 75°5′13″S, 165°2′53″E 1174 箱式样 34 A1-20 77°39′58″S, 165°53′6″E 590.1 箱式样 35 A2-02 74°12′22″S, 170°7′5″E 654 箱式样 36 A2-03 73°42′4″S, 170°58′44″E 588 箱式样 37 A2-05 72°36′18″S, 172°26′13″E 546.2 箱式样 38 A1-11 77°49′34″S, 173°47′17″W 530.4 多管样 39 A1-17 76°38′10″S, 169°23′46″E 804.5 多管样 40 A1-09 78°5′2″S, 168°57′7″W 586 重力样 41 A1-13 77°32′42″S, 178°1′16″W 663.8 重力样 42 ANT35 R1-03 74°59′43″, 168°21′28″E 348.6 箱式样 43 注:除标注外,其他站位的样品为0~2 cm表层沉积物;序号位置见图1。 此外,本文共收集前人已发表的118个站位的表层沉积物生源组分数据。生物硅数据(30个)来自Burckle等 [22];碳酸钙数据(39个)来自Hauck等[9];TOC数据(48个)和δ13Corg数据(45个)来自Andrews等 [23]、Ohkouchi等 [24]和Villinski等 [25]。
2.2 方法
2.2.1 实验方法
本文对采自罗斯海陆架区的43个表层沉积物样品进行生物硅、碳酸钙、总有机碳和总氮等指标的百分含量,以及有机碳同位素进行了测量。所有测试都在同济大学海洋地质国家重点实验室完成,测试方法参照该实验室标准方法。
生物硅含量测量参照Mortlock和Froelich [26],首先用碳酸钠提取沉积物中生物硅,之后用硅钼蓝比色法测量其含量,该方法的误差小于3%。
碳酸钙含量使用NFP18-508仪器,采用气体定量分析技术,通过测量碳酸盐和盐酸反应放出的CO2的体积计算碳酸盐含量,该方法误差小于1%。
TOC和TN含量由Elementar Vario Cube有机元素分析仪测定:称取0.2 g样品置于试管内,加入盐酸去除无机碳;加入去离子水洗净残余的酸;将样品低温(40 ºC)烘干后包样上机测试其含量。测量结果的相对标准偏差小于1%。
δ13Corg测量使用Finnigan 253 Plus仪器,测量结果的标准偏差小于0.2‰。
2.2.2 统计方法
为了分析各指标之间以及各样品之间的相互关系,本文采用了K-means聚类分析方法和因子分析方法。K-means聚类分析算法根据Arthur和Vassilvitskii模型[27],旨在选择最小化惯性或质心内平方和之和的质心,采用欧几里得距离公式:
$$ \sum _{i=0}^{n}\begin{array}{c}\min\\ {u}_{j}\in c\end{array}{(||{x}_{j}-{\mu }_{i}||}^{2}) $$ 其中,xj为样本值,c为簇样本值总和,ui为每个簇的平均值。K-means分析的变量输入为δ13Corg和C/N,共36个站位样本(43个总样本中有7个站位无δ13Corg数据)。该组变量是区分有机质来源的指标参数[3],同一来源的有机质可以通过该算法划分在同一簇内从而进行来源分析。
因子分析共36个站位样本,输入变量为TOC、TN、Opal、CaCO3、δ13Corg,目的是找寻聚类分析获得的簇受到的主要环境因素的影响。因子分析算法是多元统计分析中常用的一种降维方式。首先通过Bartlett球形检验[28]和KMO值[29]检验各个因子的独立性来确定该数据是否适合因子分析。Bartlett球形检验P值越接近0、KMO值越接近1代表各因子适合进行因子分析。没有加入C/N因子是因为C/N比值是TOC与TN计算的结果,加入后KMO值只有0.42无法进行因子分析。因子分析通过主成分析方法(PCA)将累计方差总贡献率>85%的因子个数作为公共因子个数。通过回归方法获得载荷因子得分系数,从而计算各站位的因子得分。正交因子模型为:
$$ {X}_{P\times 1}=\mu +{L}_{P\times m}F+\epsilon $$ 其中,LP×m为公共因子负荷矩阵,F为公共因子载荷矩阵。ϵ为特殊因子矩阵。XP×1为观测值。
K-means聚类分析和因子分析均在Python上完成(聚类分析调用sklearn.kmeans库,因子分析调用Factor_Analysis库)。
3. 结果
3.1 Opal、CaCO3、TOC、TN百分含量,C/N比值及δ13Corg分布
罗斯陆架内32个站位的Opal数据来自前人数据[30],10个站位数据来自本项研究,共42个站位数据。其中最大值(31.1%)出现在R20站位,最小值(1.5%)出现在R18站位,标准差为7.6%(站位位置见图1,表1)。Opal高值区域位于西南陆架冰间湖地区Joides海槽和Drygalski海槽东北向区域(图3A)。低值区域位于阿代尔角以及中部陆架的南部。
![]() 图 3 罗斯海表层沉积物生源分布图A-F:来自本研究(圆圈)以及前人(三角)的罗斯海陆架表层沉积物Opal、碳酸钙、TOC、TN含量,C/N,δ13Corg平面分布图Figure 3. Distribution of biogenic components in surface sediments of the Ross SeaA-F: opal, carbonate, TOC, TN, C/N, δ13Corg values in surface sediments from the Ross Sea shelf from this study (circles) and published data (triangles).
图 3 罗斯海表层沉积物生源分布图A-F:来自本研究(圆圈)以及前人(三角)的罗斯海陆架表层沉积物Opal、碳酸钙、TOC、TN含量,C/N,δ13Corg平面分布图Figure 3. Distribution of biogenic components in surface sediments of the Ross SeaA-F: opal, carbonate, TOC, TN, C/N, δ13Corg values in surface sediments from the Ross Sea shelf from this study (circles) and published data (triangles).碳酸钙含量在RSP区域罗斯浅滩(Ross Bank,RB)和阿代尔角显示高值,分别位于R19(6.5%)、RB11B(3.9%)和 A1-15(6.3%)三个站位,其他站位含量几乎为0(图3B)。
43个表层样品TOC含量的平均值为0.81%,其中最大值(1.36%)出现在R16站位,最小值(0.16%)在R18站位,标准差为0.3%。西南陆架冰间湖地区(MSP、TNBP、RSP),Joides海槽西部与Drygalski海槽南部交汇处的沉积物中有较高的TOC含量;低值区域位于阿代尔角附近和Glomar Challenger海槽北部地区(图3C)。TN含量平均值为0.11%。其中最高值(0.25%)出现在A1-09站位,最低值(0.014%)出现在R18站位,标准差为0.05%。TN百分含量高值范围与TOC相似,位于西南陆架冰间湖以及Joides海盆西部与Drygalski海槽南部的交汇处。低值区域位于阿代尔角附近和Glomar Challenger海槽北部地区(图3D)。
由TOC和TN含量计算得到罗斯陆架区域C/N比值平均为7.7,标准差为2.3,最大值(16.8)出现在R19站位,最低值(3.2)出现在RB02B站位。C/N在阿代尔角沿岸为高值,向东南方向递减,在Glomar Challenger海槽北部陆架地区出现最低值(图3E)。
罗斯海陆架上36个站位的沉积物δ13Corg最小值(−28.1%)出现在JB06站位,最大值(−23.7%)出现在R18站位。在TNBP地区显示重值(图3F),在中央陆架地区显示低值,平均值为−26.3%。
3.2 统计分析结果
K-means聚类分析模型的参数为C/N和δ13Corg。K-means聚类分析显示簇数为6时,簇内误方差(SSE)变化平稳,SSE在10以内,代表结果收敛。
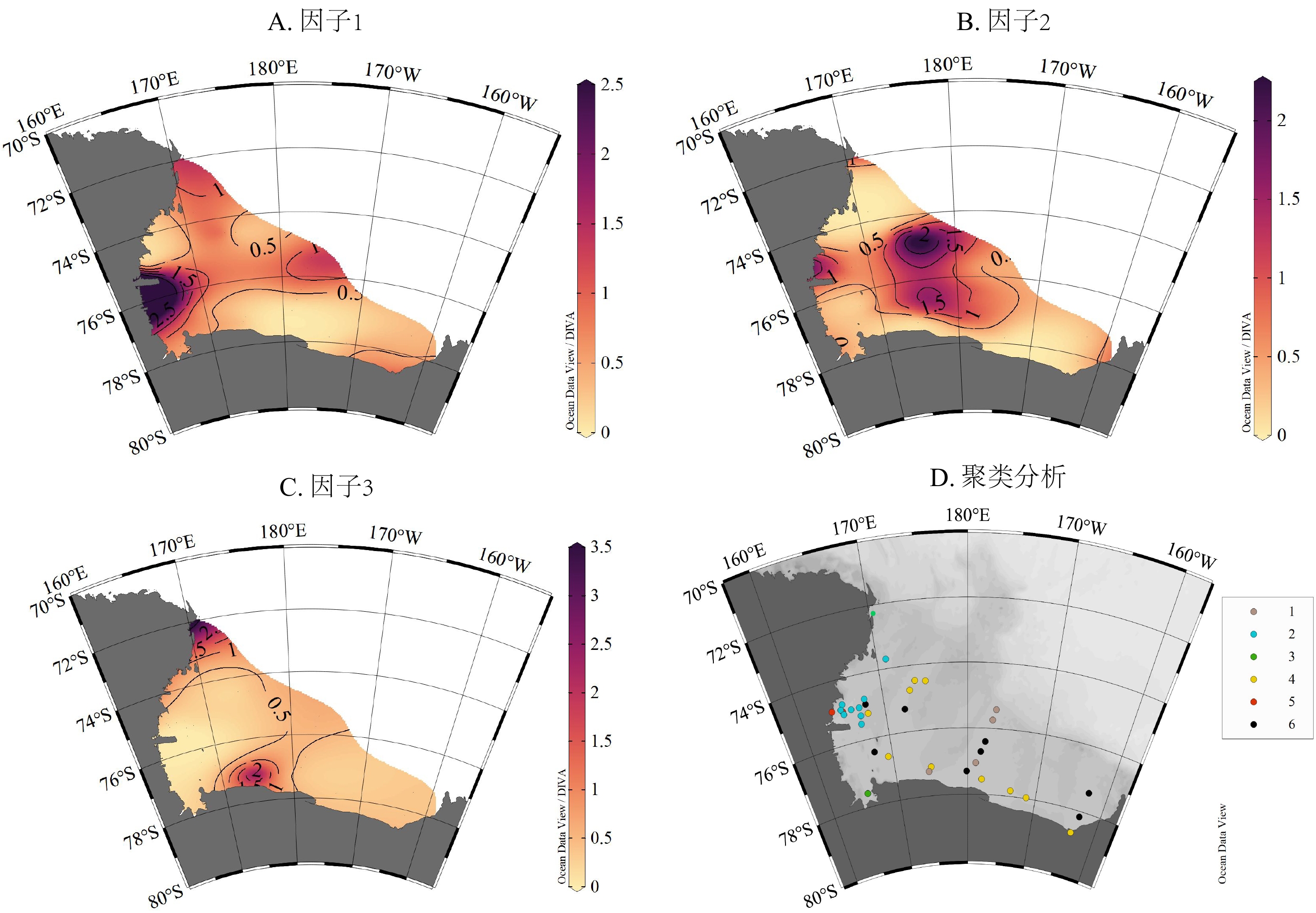
因子分析方法可以分析各个聚类簇代表的环境影响因素,36个站位的因子得分分布图将整个陆架区域划分为三大生源组分特征区域(图4)。
![]() 图 4 罗斯海陆架3个公共因子得分分布(A-C)以及聚类分析各簇在罗斯陆架上平面分布情况(D)其中2、5簇大致对应因子1高得分站位分布,1、4、6簇大致对应因子2高得分站位分布,3簇大致对应因子3高得分站位分布。Figure 4. Distribution of factor scores for the three common factors on the Ross Sea shelf (A-C) and cluster analysis of the distribution of each cluster on the Ross shelf (D)Where clusters 2 and 5 correspond roughly to the distribution of factor 1 scores; clusters 1, 4 and 6 roughly to the distribution of factor 2 scores; and cluster 3 roughly to the distribution of factor 3 scores.
图 4 罗斯海陆架3个公共因子得分分布(A-C)以及聚类分析各簇在罗斯陆架上平面分布情况(D)其中2、5簇大致对应因子1高得分站位分布,1、4、6簇大致对应因子2高得分站位分布,3簇大致对应因子3高得分站位分布。Figure 4. Distribution of factor scores for the three common factors on the Ross Sea shelf (A-C) and cluster analysis of the distribution of each cluster on the Ross shelf (D)Where clusters 2 and 5 correspond roughly to the distribution of factor 1 scores; clusters 1, 4 and 6 roughly to the distribution of factor 2 scores; and cluster 3 roughly to the distribution of factor 3 scores.3.2.1 西南陆架冰间湖区域
该区域是因子1的高因子得分区域。因子1的主要因子为TOC、TN、Opal,占方差变化的85%。因子得分高值位于西南陆架冰间湖,代表站位分别是R20、A1-18、 R16(位置见图1,表1),大致对应聚类分析的2、5簇。这些簇的质心δ13 C较重,其因子特征值为2.48,是3个因子中最为稳健的因子,其贡献46%的方差变化,占主要成分。
3.2.2 中东部陆架盆地海槽区域
该区域是因子2的高因子得分区域。因子2的主要因子是δ13 Corg,占方差变化的63%,特征值为1.14,贡献了约21%的方差变化。因子得分高值位于Drygalski、Joides、Glomar Challenger海槽,代表站位分别是R18、RB16B、R02(图1,表1),大致对应聚类分析的1、4、6簇,这些簇的质心δ13 C值较轻。
3.2.3 阿代尔角沿岸外陆架区域
该区域是因子3的高因子得分区域。因子3的主要因子为碳酸钙,占方差变化的81%,特征值为0.78,贡献率为20.1%。因子得分高值位于RSP和阿代尔角附近,代表站位分别是R19、RB11B、A1-15(图1,表1),大致对应聚类分析的3簇。该簇质心具有高C/N比。
3.3 相关性检验
TOC、TN、Opal相关系数矩阵数值高,代表这3个因子有相关性。TOC、TN相关性很强,相关系数R2达0.818;TOC、TN与Opal的相关性相对来说较差,R2分别为0.246和0.37;δ13Corg、CaCO3、C/N相关系数矩阵数值低,小于0.01,代表这些因子相互独立。
4. 讨论
4.1 表层沉积物年龄
表层沉积物参数与现代环境对比的前提是表层沉积物沉积时期的海洋环境与现代类似。因此,对表层沉积物年龄的控制是后续讨论的前提。AMS 14C测年显示,罗斯海东部和中央陆架表层沉积物的平均年龄为3148 aBP,最大年龄为4525 aBP,地处罗斯中央冰架前缘;最小值为2210 aBP,地处Little American海盆[23]。此外,西北扇区的JB-06站位表层沉积物年龄为825 aBP[31]。由于西南扇区的沉积物沉积速率较东部和中部更高,推测其表层沉积物年龄不大于东部陆架表层沉积物年龄[32]。因此,罗斯陆架的表层沉积物基本代表了晚全新世以来的沉积环境[15,33]。研究显示,罗斯冰架在晚全新世5 ka时期退缩到现在位置,形成与现代相似的水文和沉积环境。因此,本文所研究的表层沉积物参数可与现代环境对比。
4.2 生源组分分布特征
根据因子分析结果,罗斯海陆架沉积物的生源组分的分布可划分为3个特征区域:西南陆架冰间湖区域(TOC、TN、Opal为主要因子),中东部陆架盆地海槽区域(δ13Corg为主要因子),以及靠近阿代尔角沿岸的外陆架区域(碳酸钙为主要因子),与前人通过表层生产力和沉积速率指标分类的结果大致相同[16,32-33]。相比之下,本文考虑了内外水体物质交换(如CDW)对沉积物生源物质分布的影响,弥补了前人研究的不足。
4.2.1 TOC、TN、Opal分布特征及环境影响因子
TOC、TN、Opal在罗斯陆架的西南部和东部含量较高,中部含量较低(图3A, C, D)。这个分布特征与遥感数据显示的叶绿素含量相符(图2C, F),说明表层沉积物的这3个指标可以反映水体生产力的情况。这3个指标是因子1的主要变量,该因子得分高的站位分布在西南陆架冰间湖。TOC,TN与Opal并没有很好的线性关系,罗斯海陆架中南部Opal含量较低,但TOC含量较高(图3A, C, D),代表硅藻不是唯一的生产力主控群落。非硅质浮游生物定鞭藻(主要属种Phaeocytis antarctica)是罗斯海主要的浮游藻类,主要位于罗斯海中南部RSP地区[1,3,11,17,34]。RSP硅藻勃发较差的原因可能是该地区混合层较深。Leventer等[34]发现硅藻主要勃发在上层水体层化稳定的环境中,Sweeney等[13]认为表层水温度偏暖有利于硅藻勃发同时导致混合层变浅。TOC、TN与Opal保存的差异性也会略微降低它们的相关性。罗斯海沉积物中Si/C比值是颗粒物质沉积水界面Si/C比值的两倍,充分说明TOC的保存相比Opal较差[35]。
生产力受到海冰、混合层深度、光照强度以及营养盐供给等因素影响[1,11,13]。在南半球春、夏季生物勃发期间整个罗斯海陆架表层海水主要的营养盐(如硝酸盐,硅酸盐)过剩(图2A, B, D, E),因此,营养盐供应并非罗斯海陆架生产力限制因素[1]。西南陆架冰间湖为无海冰覆盖区域,解除了光照对生物生长的限制。同时,西南陆架冰间湖的下降风增强了风尘铁的输入促使藻类的勃发以及沉积[3, 36-37]。特拉诺瓦湾冰间湖的CO2通量最大说明了冰间湖是高生产力地区[38],季节性海冰覆盖的东部陆架埋藏的TOC、Opal以及叶绿素含量均高于西南陆架冰间湖地区(图2C, F;图3A, C),可能与该地区绕极深层水的上涌有关。东北部陆坡处分布厚层绕极深层水[16],其中向南的分支上涌至陆架形成变性绕极深层水。该水团融化东南陆架季节性海冰,造成在海冰间隙生长的冰藻大量沉积[39]。同时,这种深部对流带来的溶解铁促成硅藻勃发[1]。绕极深层水深部对流带来的铁离子占罗斯海陆架溶解铁的60%,远高于风尘铁的输入[14]。前人研究发现该地区含有大量溶解铁,说明铁离子含量过剩[14,40-42],铁离子浓度不再是硅藻生长勃发的限制因素[17],弥补了低透光率的不足,从而导致浮游生物生产力增加[43-44]。由于溶解铁的缺乏[1,19-20],阿代尔角生产力指标含量较低,是高硝酸盐低叶绿素生产力限制区域。综上,罗斯海陆架生产力主要受溶解铁含量的影响,罗斯海陆架高生产力区域分布在溶解铁含量较高的区域。光照强度不是重要的生产力限制因素,因为季节性海冰的后退带来了冰藻,硅藻沉积可以弥补低光照对生产力的限制。混合层深度主要影响藻类勃发的优势属种,影响沉积物中Opal的含量。
4.2.2 δ13Corg分布特征及其影响因素
δ13Corg在罗斯陆架西部较重而在中部海槽盆地较轻(图3F),和前人数据的分布大体一致[25]。δ13Corg是因子2的主要变量,该因子得分高值的站位大致对应聚类簇的1、4、6,分布在Drygalski、Joides、Glomar Challenger海槽地区。这些海槽沉积物中δ13Corg值较轻,最低值为−29%。结合前人45个站位的δ13Corg信息[23-25],发现13Corg重值分布于具有高生产力的特拉诺瓦湾冰间湖和东北陆架地区(图3F),表示δ13Corg的重值指示了较高的表层海水初级生产力。海槽区沉积物13Corg轻值指示受到陆源输入的影响[23-25,45]。高盐陆架水可能携带陆源物质通过海槽外流也造成海槽地区13Corg变轻[23-24,45-46]。而海源有机碳更容易分解,导致δ13Corg负偏的陆源有机碳相对富集 [25,47]。由于13Corg受到除生产力以外的因素影响,13Corg与因子一相关性较差。值得注意的是,C/N在中南陆架最低值为5,代表海洋藻生,与13Corg的指示结果相悖(图3 E, F),可能由于有机碳的降解导致沉积物中氮相对富集,从而降低了C/N比[6]。相比之下,13Corg受降解的影响较小[24-25]。LGM以来,东西南极冰盖的融冰水通过海槽流入罗斯海陆架 [15],与13Corg低值范围大致相符,代表13Corg能较好地指示有机质来源。
4.2.3 碳酸钙分布特征及环境影响因素
罗斯海陆架上碳酸钙含量很低,仅在罗斯海冰间湖地区和阿代尔角沿岸地区出现高值,与前人的结果相符(图3B)[9]。相比之下,本文增加了位于罗斯海冰间湖前缘的罗斯海浅滩地区的样品,并发现了该地区碳酸钙含量较高(图1, 图3B)。
碳酸钙是因子3的主要变量,该因子得分分布高值的站位大致对应聚类3簇,分布在阿代尔角和罗斯浅滩(罗斯海冰间湖地区)。沉积物中碳酸钙的含量主要受钙质生物生产力[48]和保存效率的影响[12]。在高生产力的西南陆架冰间湖区域碳酸钙含量较高(图3B),指示该地区钙质生物生产力较高且保存较好[9,47,49]。罗斯海主要的钙质生物为文石类(如翼足类Limacina helicina),不易保存[50]。pH值较低的绕极深层水通过海槽上涌至陆架,侵蚀钙质壳体[51],造成中东部海槽盆地地区碳酸钙含量难以保存[9]。生产力较高的东部陆架碳酸钙含量却较低,也代表碳酸钙的保存受到绕极深层水的影响。此外,绕极深层水上涌还造成东南部陆架季节性海冰的融化。冰融水的稀释使水体的碳酸钙不饱和,促进了碳酸钙的溶解[9,16,49]。生产力受限制的阿代尔角(高硝酸盐低叶绿素区域)与西南陆架冰间湖(高生产力地区)相比埋藏了较多的碳酸钙(图3B),推测与该地区有利的碳酸钙保存环境有关。相比西南陆架冰间湖,该地区TOC含量低并且通风性较差,由此限制了沉积物中因为TOC被氧化而使得孔隙水pH值降低,因此利于碳酸钙在沉积物中的保存[48]。此外,阿代尔角的R19站位富含黑色砂砾,其C/N比值最高,δ13Corg较轻(−26%)(图3E, F)代表该地区接受了来自陆架水的陆源碎屑[6]。全新世以来,从特拉诺瓦湾冰间湖产生的高碱度陆架水的输入造成阿代尔角地区深部水体碱度高,利于碳酸钙的沉积[51-53]。同时,高速南极陆坡流的筛选作用导致该地区沉积物粒度较高,有利于碳酸钙物质进入砂质沉积物保存下来[9,54]。
5. 结论
(1)溶解铁是影响罗斯海陆架生产力的主要影响因素,高溶解铁含量区域(冰间湖以及东南陆架)生产力偏高,尤其是东南陆架,绕极深层水上涌为该地区提供了营养盐和溶解铁,同时温暖的绕极深层水还会造成海冰融化,促进生产力。混合层深度影响藻类勃发的优势属种,高生产力的特拉诺瓦湾冰间湖附近 δ13Corg值较重。陆源遗迹碳的输入和富集影响δ13Corg的轻值分布。碳酸钙的保存受绕极深层水以及南极陆坡流的影响,绕极深层水融化海冰会稀释水体碳酸钙的饱和度,减弱碳酸钙的保存,南极陆坡流的筛选作用利于碳酸钙的保存。
(2)因子分析和K-means聚类分析将罗斯海陆架地区划分为3类环境影响区域:西南陆架冰间湖地区(主要影响TOC、TN、Opal的变化,代表水体生产力),海槽盆地地区(主要影响δ13Corg的变化,受陆架水流出的影响,是内外陆架水流交换区域),位于阿代尔角沿岸靠外陆架地区(主要变量为碳酸钙,特征为高C/N以及低δ13Corg,代表其为高陆源输入区域)。
致谢:感谢中国第31-35次南极科考队为沉积物样品的采集所付出的艰辛努力。感谢中国极地研究中心提供沉积样品。
-
图 1 南极罗斯海陆架区概况[2]与2002—2011年南半球夏季海冰分布范围(https://earthdata.nasa.gov)
SSI:年均夏季海冰界限,AASW:南极表层水, CDW:绕极深层水, MCDW:变性绕极深层水,SW:陆架水,ASC:南极陆坡流,MSP:麦克默多湾冰间湖,RSP:罗斯海冰间湖, TNBP:特拉诺瓦湾冰间湖,DT:Drygalski海槽,JT:Joides海槽,GCT:Glomar Challenger海槽,JB:Joides海盆,RB:罗斯浅滩。
Figure 1. Ross Sea physiographic and oceanographic map with site locations
Average Summer Sea Ice (SSI) extent (2002-2011) is from https://earthdata.nasa.gov. AASW: Antarctic Surface Water, CDW: Deep Circumpolar Water, MCDW: Modified Circumpolar Deep Water, SW: Shelf Water, ASC: Antarctic Slope Current, MSP: McMurdo Sound Polynya, RSP: Ross Sea Polynya, TNBP: Terra Nova Bay Polynya, DT: Drygalski Trough, JT: Joides Trough, GCT: Glomar Challenger Trough, JB: Joides Basin, RB: Ross Bank.
图 2 罗斯海表层海水营养盐浓度分布图
A,B: 1955—2012年 罗斯海春季(10—12月)硅酸盐和硝酸盐在10 m水深的浓度;C,D:1955—2012年罗斯海夏季(1—3月)硅酸盐和硝酸盐在10 m水深浓度,改编自文献[21];E: 2009年南半球春季叶绿素月平均值;F: 2010年南半球夏季叶绿素浓度值。叶绿素分布来自https://oceanwatch.pifsc.noaa.gov/erddap/griddap
Figure 2. Nutrient and chlorophyll concentration in Ross sea surface water
A, B: 1955-2012 Southern Hemisphere spring (October-December) silicate and nitrate concentration at 10 m water depth; C, D: 1955-2012 Ross Sea summer (January-March) silicate, nitrate concentration at 10 m water depth; E: spring chlorophyll concentration in 2009; F: Summer chlorophyll concentration in 2010. Chlorophyll distribution are from https://oceanwatch.pifsc.noaa.gov/erddap/griddap
图 3 罗斯海表层沉积物生源分布图
A-F:来自本研究(圆圈)以及前人(三角)的罗斯海陆架表层沉积物Opal、碳酸钙、TOC、TN含量,C/N,δ13Corg平面分布图
Figure 3. Distribution of biogenic components in surface sediments of the Ross Sea
A-F: opal, carbonate, TOC, TN, C/N, δ13Corg values in surface sediments from the Ross Sea shelf from this study (circles) and published data (triangles).
图 4 罗斯海陆架3个公共因子得分分布(A-C)以及聚类分析各簇在罗斯陆架上平面分布情况(D)
其中2、5簇大致对应因子1高得分站位分布,1、4、6簇大致对应因子2高得分站位分布,3簇大致对应因子3高得分站位分布。
Figure 4. Distribution of factor scores for the three common factors on the Ross Sea shelf (A-C) and cluster analysis of the distribution of each cluster on the Ross shelf (D)
Where clusters 2 and 5 correspond roughly to the distribution of factor 1 scores; clusters 1, 4 and 6 roughly to the distribution of factor 2 scores; and cluster 3 roughly to the distribution of factor 3 scores.
表 1 ANT31-35航次表层样信息
Table 1 Information of the studied surface sediment samples retrieved from ANT 31-35 expeditions
航次 站位号 位置 水深/m 取样方式 序号 ANT31 JB01 77°35′18″S, 165°34′10″E 774 箱式样 1 JB04(0~10 cm) 75°18′04″S, 172°22′21″E 510.8 箱式样 2 JB05(0~5 cm) 74°45′19″S, 173°11′17″E 496.8 箱式样 3 R02 74°47′6″S, 165°7′59″E 719.2 箱式样 4 R05(0~5 cm) 74°46′36″S, 167°46′39″E 585.6 箱式样 5 R08 75°00′11″S, 165°00′43″E 891.8 箱式样 6 R09 75°00′12″S, 165°59′53″E 1032.1 箱式样 7 R10 74°59′68″S, 167°00′07″E 636 箱式样 8 R11(0~5 cm) 74°56′57″S, 167°48′20″E 449.4 箱式样 9 R14 74°56′06″S, 164°48′17″E 901.1 箱式样 10 R17 75°13′49″S,167°54′33″E 374.4 箱式样 11 R18 74°54′46.8″S, 163°45′50′E 46 箱式样 12 R19 72°15′16″S, 170°23′40″E 516.3 箱式样 13 R16 75°15′15″S, 166°59′50″E 486.74 多管样 14 R20 75°30′16″S, 166°50′52″E 425.59 多管样 15 JB06 74°28′22″S, 173°54′24″E 567.52 重力样 16 AB18B 71°53′55″S, 128°8′42″W 3463 箱式样 17 ANT32 RB02B 75°25′24″S, 176°29′9″W 574 箱式样 18 RB03B 75°44′48″S, 176°52′11″W 610 箱式样 19 RB05B 76°24′19″S, 177°43′10″W 606 箱式样 20 RB06B 76°42′48″S, 178°14′25″W 619 箱式样 21 RB07B 77°02′59″S, 178°54′01″W 628.3 箱式样 22 RB08B 77°18′32″S, 179°51′09″E 669.7 箱式样 23 RB11B 77°16′10″S, 174°35′59″E 494.9 箱式样 24 RB16B 74°30′49″S, 175°07′18″E 478 箱式样 25 RB15C 77°12′7″S, 168°47′19″E 939.8 重力样 26 A1-05 77°23′46″S, 162°40′41″W 658.3 箱式样 27 ANT33 A1-07 78°10′5″S, 163°2′20″W 678.8 箱式样 28 A1-08 78°10′19″S, 165°47′17″W 497.6 箱式样 29 RS78 78°41′38″S, 163°40′1″W 331.06 箱式样 30 A1-10 77°58′5″S, 171°22′23″W 514.9 箱式样 31 A1-15 77°7′37″S, 174°57′50″E 399.9 箱式样 32 A1-18 76°25′16″S, 167°43′26″E 742.8 箱式样 33 I5 75°5′13″S, 165°2′53″E 1174 箱式样 34 A1-20 77°39′58″S, 165°53′6″E 590.1 箱式样 35 A2-02 74°12′22″S, 170°7′5″E 654 箱式样 36 A2-03 73°42′4″S, 170°58′44″E 588 箱式样 37 A2-05 72°36′18″S, 172°26′13″E 546.2 箱式样 38 A1-11 77°49′34″S, 173°47′17″W 530.4 多管样 39 A1-17 76°38′10″S, 169°23′46″E 804.5 多管样 40 A1-09 78°5′2″S, 168°57′7″W 586 重力样 41 A1-13 77°32′42″S, 178°1′16″W 663.8 重力样 42 ANT35 R1-03 74°59′43″, 168°21′28″E 348.6 箱式样 43 注:除标注外,其他站位的样品为0~2 cm表层沉积物;序号位置见图1。 -
[1] Smith W O Jr, Ainley D G, Arrigo K R, et al. The oceanography and ecology of the Ross Sea [J]. Annual Review Marine Science, 2014, 6: 469-487. doi: 10.1146/annurev-marine-010213-135114
[2] Morrison A K, Frölicher T L, Sarmiento J L. Upwelling in the Southern Ocean [J]. Physics Today, 2015, 68(1): 27-32. doi: 10.1063/PT.3.2654
[3] Tremblay J E, Smith W O Jr. Primary production and nutrient dynamics in polynyas [J]. Elsevier Oceanography Series, 2007, 74: 239-269.
[4] Parish T R, Cassano J J, Seefeldt M W. Characteristics of the ross ice shelf air stream as depicted in Antarctic mesoscale prediction system simulations [J]. Journal of Geophysical Research:Atmospheres, 2006, 111(D12): D12109. doi: 10.1029/2005JD006185
[5] Catalano G, Budillon G, La Ferla R, et al. The ross sea[M]//Liu K K, Atkinson L, Quinones R, et al. Carbon and nutrient Fluxes in Continental Margins: A Global Synthesis. New York: Springer-Verlag, 2010, 6: 303-318.
[6] Thornton S F, McManus J. Application of organic carbon and nitrogen stable isotope and C/N ratios as source indicators of organic matter provenance in estuarine systems: evidence from the Tay Estuary, Scotland [J]. Estuarine, Coastal and Shelf Science, 1994, 38(3): 219-233. doi: 10.1006/ecss.1994.1015
[7] Emerson S, Hedges J I. Processes controlling the organic carbon content of open ocean sediments [J]. Paleoceanography, 1988, 3(5): 621-634. doi: 10.1029/PA003i005p00621
[8] Stein R. Accumulation of organic carbon in marine sediments[M]. Berlin: Springer-Verlag, 1991: 217-320.
[9] Hauck J, Gerdes D, Hillenbrand C D, et al. Distribution and mineralogy of carbonate sediments on Antarctic shelves [J]. Journal of Marine Systems, 2012, 90(1): 77-87. doi: 10.1016/j.jmarsys.2011.09.005
[10] Rack W, Price D, Haas C, et al. Sea ice thickness in the western Ross Sea [J]. Geophysical Research Letters, 2021, 48(1): e2020GL090866. doi: 10.1029/2020GL090866
[11] Arrigo K R, Worthen D L, Robinson D H. A coupled ocean-ecosystem model of the Ross Sea: 2. Iron regulation of phytoplankton taxonomic variability and primary production [J]. Journal of Geophysical Research:Oceans, 2003, 108(C7): 3231. doi: 10.1029/2001JC000856
[12] Nelson D M, DeMaster D J, Dunbar R B, et al. Cycling of organic carbon and biogenic silica in the Southern Ocean: Estimates of water-column and sedimentary fluxes on the Ross Sea continental shelf [J]. Journal of Geophysical Research:Oceans, 1996, 101(C8): 18519-18532. doi: 10.1029/96JC01573
[13] Sweeney C, Hansell D A, Carlson C A, et al. Biogeochemical regimes, net community production and carbon export in the Ross Sea, Antarctica [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2000, 47(15-16): 3369-3394.
[14] Marsay C M, Barrett P M, McGillicuddy D J, et al. Distributions, sources, and transformations of dissolved and particulate iron on the Ross Sea continental shelf during summer [J]. Journal of Geophysical Research:Oceans, 2017, 122(8): 6371-6393. doi: 10.1002/2017JC013068
[15] Anderson J B, Conway H, Bart P J, et al. Ross Sea paleo-ice sheet drainage and deglacial history during and since the LGM [J]. Quaternary Science Reviews, 2014, 100: 31-54. doi: 10.1016/j.quascirev.2013.08.020
[16] Orsi A H, Wiederwohl C L. A recount of Ross Sea waters [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2009, 56(13-14): 778-795. doi: 10.1016/j.dsr2.2008.10.033
[17] Peloquin J A, Smith W O Jr. Phytoplankton blooms in the Ross Sea, Antarctica: Interannual variability in magnitude, temporal patterns, and composition [J]. Journal Geophysical Research:Oceans, 2007, 112(C8): C08013.
[18] Sedwick P N, DiTullio G R, Mackey D J. Iron and manganese in the Ross Sea, Antarctica: Seasonal iron limitation in Antarctic shelf waters [J]. Journal of Geophysical Research:Oceans, 2000, 105(C5): 11321-11336. doi: 10.1029/2000JC000256
[19] Arrigo K R, Van Dijken G L. Annual changes in sea-ice, chlorophyll a, and primary production in the Ross Sea, Antarctica [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2004, 51(1-3): 117-138. doi: 10.1016/j.dsr2.2003.04.003
[20] Smith W O, Nelson D M. Phytoplankton bloom produced by a receding ice edge in the Ross Sea: spatial coherence with the density field [J]. Science, 1985, 227(4683): 163-166. doi: 10.1126/science.227.4683.163
[21] Garcia H, Locarnini R A, Boyer T P, et al. Nutrients (phosphate, nitrate, silicate)[Z]. World Ocean Atlas 2005, 2010, 4.
[22] Burckle L H. Distribution of opal in surface sediments, compiled from different sources[Z]. PANGAEA, 2001.
[23] Andrews J T, Domack E W, Cunningham W L, et al. Problems and possible solutions concerning radiocarbon dating of surface marine sediments, Ross Sea, Antarctica [J]. Quaternary Research, 1999, 52(2): 206-216. doi: 10.1006/qres.1999.2047
[24] Ohkouchi N, Eglinton T I. Radiocarbon constraint on relict organic carbon contributions to Ross Sea sediments [J]. Geochemistry, Geophysics, Geosystems, 2006, 7(4): Q04012.
[25] Villinski J C, Dunbar R B, Mucciarone D A. Carbon 13/Carbon 12 ratios of sedimentary organic matter from the Ross Sea, Antarctica: A record of phytoplankton bloom dynamics [J]. Journal of Geophysical Research:Oceans, 2000, 105(C6): 14163-14172. doi: 10.1029/1999JC000309
[26] Mortlock R A, Froelich P N. A simple method for the rapid determination of biogenic opal in pelagic marine sediments [J]. Deep Sea Research Part A. Oceanographic Research Papers, 1989, 36(9): 1415-1426. doi: 10.1016/0198-0149(89)90092-7
[27] Arthur D, Vassilvitskii S. K-Means++: the advantages of careful seeding[C]//Proceedings of the Eighteenth Annual ACM-SIAM Symposium on Discrete Algorithms, SODA 2007. New Orleans, Louisiana, USA: ACM, 2007: 1027-1035.
[28] Reddon J R, Jackson D N. A note on testing the sphericity hypothesis with Bartlett’s test [J]. Multivariate Experimental Clinical Research, 1984, 7(1): 49-52.
[29] Kaiser H F, Rice J. Little Jiffy, Mark Iv [J]. Educational and Psychological Measurement, 1974, 34(1): 111-117. doi: 10.1177/001316447403400115
[30] 滕聿央, 王汝建. 南极罗斯海表层沉积物中的放射虫组合分布及与其他硅质生物关系和环境生态意义[J]. 微体古生物学报, 2019, 36(4):377-398 TENG Yuyang, WANG Rujian. Biogenic silica and radiolarian assemblages in the surface sediments of Ross Sea, Antarctica and their implications on marine environment and ecology [J]. Acta Micropalaeontologica Sinica, 2019, 36(4): 377-398.
[31] 黄梦雪, 王汝建, 肖文申, 等. 罗斯海西北陆架(JOIDES海槽)末次冰期以来冰架消融过程及水动力变化[J]. 海洋地质与第四纪地质, 2016, 36(5):97-108 HUANG Mengxue, WANG Rujian, XIAO Wenshen, et al. Retreat process of ross ice shelf and hydrodynamic changes on northwestern ross continental shelf since the last glacial [J]. Marine Geology & Quaternary Geology, 2016, 36(5): 97-108.
[32] Langone L, Frignani M, Labbrozzi L, et al. Present-day biosiliceous sedimentation in the northwestern Ross Sea, Antarctica [J]. Journal of Marine Systems, 1998, 17(1-4): 459-470. doi: 10.1016/S0924-7963(98)00058-X
[33] Bentley M J, Cofaigh C Ó, Anderson J B, et al. A community-based geological reconstruction of Antarctic Ice Sheet deglaciation since the Last Glacial Maximum [J]. Quaternary Science Reviews, 2014, 100: 1-9. doi: 10.1016/j.quascirev.2014.06.025
[34] Leventer A, Dunbar R B. Factors influencing the distribution of diatoms and other algae in the Ross Sea [J]. Journal of Geophysical Research:Oceans, 1996, 101(C8): 18489-18500. doi: 10.1029/96JC00204
[35] DeMaster D J, Ragueneau O, Nittrouer C A. Preservation efficiencies and accumulation rates for biogenic silica and organic C, N, and P in high-latitude sediments: The Ross Sea [J]. Journal of Geophysical Research:Oceans, 1996, 101(C8): 18501-18518. doi: 10.1029/96JC01634
[36] Winton V H L, Dunbar G B, Bertler N A N, et al. The contribution of aeolian sand and dust to iron fertilization of phytoplankton blooms in southwestern Ross Sea, Antarctica [J]. Global Biogeochemical Cycles, 2014, 28(4): 423-436. doi: 10.1002/2013GB004574
[37] Winton V H L, Dunbar G B, Atkins C B, et al. The origin of lithogenic sediment in the south-western Ross Sea and implications for iron fertilization [J]. Antarctic Science, 2016, 28(4): 250-260. doi: 10.1017/S095410201600002X
[38] DeJong H B, Dunbar R B. Air-sea CO2 exchange in the Ross Sea, Antarctica [J]. Journal of Geophysical Research:Oceans, 2017, 122(10): 8167-8181. doi: 10.1002/2017JC012853
[39] Tesi T, Belt S T, Gariboldi K, et al. Resolving sea ice dynamics in the north-western Ross Sea during the last 2.6 ka: From seasonal to millennial timescales [J]. Quaternary Science Reviews, 2020, 237: 106299. doi: 10.1016/j.quascirev.2020.106299
[40] Rivaro P, Ardini F, Vivado D, et al. Potential sources of particulate iron in surface and deep waters of the terra Nova Bay (Ross Sea, Antarctica) [J]. Water, 2020, 12(12): 3517. doi: 10.3390/w12123517
[41] Mack S L, Dinniman M S, McGillicuddy D J Jr, et al. Dissolved iron transport pathways in the Ross Sea: Influence of tides and horizontal resolution in a regional ocean model [J]. Journal of Marine Systems, 2017, 166: 73-86. doi: 10.1016/j.jmarsys.2016.10.008
[42] Salmon E, Hofmann E E, Dinniman M S, et al. Evaluation of iron sources in the Ross Sea [J]. Journal of Marine Systems, 2020, 212: 103429. doi: 10.1016/j.jmarsys.2020.103429
[43] De Baar H J W, Boyd P W, Coale K H, et al. Synthesis of iron fertilization experiments: from the iron age in the age of enlightenment [J]. Journal of Geophysical Research:Oceans, 2005, 110(9): C09S16.
[44] Tsuda A, Takeda S, Saito H, et al. A mesoscale iron enrichment in the western subarctic pacific induces a large centric diatom bloom [J]. Science, 2003, 300(5621): 958-961. doi: 10.1126/science.1082000
[45] 任春燕, 陈敏, 高众勇, 等. 南极普里兹湾及其邻近海域悬浮颗粒有机物的碳同位素组成及其影响因素[J]. 海洋学报, 2015, 37(12):74-84 REN Chunyan, CHEN Min, GAO Zhongyong, et al. Stable carbon isotopic composition of suspended particulate organic matter in the Prydz Bay and its adjacent areas [J]. Acta Oceanologica Sinica, 2015, 37(12): 74-84.
[46] Lamb A L, Wilson G P, Leng M J. A review of coastal palaeoclimate and relative sea-level reconstructions using δ13C and C/N ratios in organic material [J]. Earth-Science Reviews, 2006, 75(1-4): 29-57. doi: 10.1016/j.earscirev.2005.10.003
[47] Rivaro P, Ianni C, Raimondi L, et al. Analysis of physical and biogeochemical control mechanisms on summertime surface carbonate system variability in the western Ross Sea (Antarctica) using in situ and satellite data [J]. Remote Sensing, 2019, 11(3): 238. doi: 10.3390/rs11030238
[48] Smith W O Jr, Comiso J C. Influence of sea ice on primary production in the Southern Ocean: A satellite perspective [J]. Journal of Geophysical Research, 2008, 113(C5): C05S93.
[49] Hunt B P V, Pakhomov E A, Hosie G W, et al. Pteropods in Southern ocean ecosystems [J]. Progress in Oceanography, 2008, 78(3): 193-221. doi: 10.1016/j.pocean.2008.06.001
[50] 韩喜彬, 赵军, 初凤友, 等. 南极半岛东北海域表层沉积有机质来源及其沉积环境[J]. 海洋学报, 2015, 37(8):26-38 HAN Xibin, ZHAO Jun, CHU Fengyou, et al. The source of organic matter and its sedimentary environment of the bottom surface sediment in northeast waters to Antarctic Peninsula based on the biomarker features [J]. Acta Oceanologica Sinica, 2015, 37(8): 26-38.
[51] Rivaro P, Messa R, Ianni C, et al. Distribution of total alkalinity and pH in the Ross Sea (Antarctica) waters during austral summer 2008 [J]. Polar Research, 2014, 33(1): 20403. doi: 10.3402/polar.v33.20403
[52] Bergamasco A, Defendi V, Budillon G, et al. Downslope flow observations near Cape Adare shelf-break [J]. Antarctic Science, 2004, 16(2): 199-204. doi: 10.1017/S0954102004001981
[53] Melis R, Salvi G. Foraminifer and ostracod occurrence in a cool-water carbonate factory of the cape Adare (Ross Sea, Antarctica): a key lecture for the climatic and oceanographic variations in the Last 30, 000 years [J]. Geosciences, 2020, 10(10): 413. doi: 10.3390/geosciences10100413
[54] Kim S, Lee J I, McKay R M, et al. Late Pleistocene paleoceanographic changes in the Ross Sea-Glacial-interglacial variations in paleoproductivity, nutrient utilization, and deep-water formation [J]. Quaternary Science Reviews, 2020, 239: 106356. doi: 10.1016/j.quascirev.2020.106356
-
期刊类型引用(1)
1. 张美茹,于兆杰,康晓莹,李鑫雨,安宁,万世明. 晚新生代东南亚岛弧风化和有机碳埋藏对碳循环的影响初探. 自然杂志. 2025(01): 40-51 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: