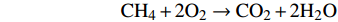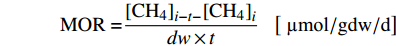Response characteristics of aerobic methane oxidation to oxygen concentration in marine habitats
-
摘要: 海洋生境来源的甲烷好氧氧化菌及其产生的甲烷氧化作用是否具有独特性,对氧浓度这一环境因子如何响应,目前尚不清楚。本文采用海底新鲜沉积物作为菌种来源,借助微生物培养技术,实验研究了不同氧浓度条件(0%、1%、10%和50%)下的甲烷好氧氧化过程。结果表明,完全无氧条件(0%)不能发生甲烷好氧氧化作用,实验体系的甲烷氧化速率及甲烷氧化菌总丰度随氧浓度升高而降低,当氧浓度由1%升高至50%时,甲烷氧化速率减弱了约15倍,甲烷氧化菌总丰度降低了两个数量级。甲烷氧化菌优势菌属为I型氧化菌Methylobacter属,由Methylobacter leteus和Methylobacter whittenburyi组成,氧浓度增加时Methylobacter leteus的占比随之降低,Methylobacter whittenburyi则相反。本实验中甲烷好氧氧化菌及其氧化作用的最适氧浓度条件为1%,这与采样位置的原始生存环境最为接近。在海底低氧条件叠加低温、高压等特殊生境的长期驯化下,甲烷氧化菌的最适氧浓度条件将逐渐趋于其原始生存环境。Abstract: It is not clear whether methanotrophs and the aerobic methane oxidation of marine habitats are unique and how they respond to oxygen concentration. In this paper, experimental investigations on the aerobic oxidation of methane were conducted under different oxygen concentrations (0%、1%、10% and 50%), using fresh seabed sediments as the source of methanotrophs. The results show that aerobic methane oxidation is rejective to anoxic condition (0%). Both the oxidation rate and abundance of methanotrophs decrease as the oxygen concentration increases. When oxygen concentration increases from 1% to 50%, the oxidation rate will decrease by about 15 times, and the total abundance of methanotrophs decreases by two orders in magnitude. The dominant methanotrophs belong to type I-Methylobacter, which consist of Methylobacter leteus and Methylobacter whittenburyi. When oxygen concentration increases, the proportion of Methylobacter leteus decreases, while that of Methylobacter whittenburyi increases. The study further suggests that the optimum oxygen concentration of methanotrophs and the aerobic methane oxidation is 1%, which is very close to the original environment of the sampling location. It means that the optimum oxygen concentration of methanotrophs will gradually approach the original living environment under a long-term acclimatization in specific biotope such as that with low oxygen concentration under low temperature and high pressure.
-
Keywords:
- marine habitats /
- methanotroph /
- aerobic methane oxidation /
- oxygen concentration
-
甲烷好氧氧化作用是由甲烷氧化细菌介导下甲烷和氧分子分别作为电子供体和电子受体的生物地球化学反应[1],主要发生于海底表层沉积物和海水中,是影响海洋生态系统、控制温室气体排放的重要生化过程[2-3]。海洋泄露环境中,不同泄露位置、泄露时刻或纵深层位的甲烷好氧氧化强度存在显著差异,每天每平方米的氧化速率跨度可从几个纳摩尔到几百个毫摩尔,与之相应的甲烷氧化菌群落结构也不尽相同[4],造成这一现象的原因可能是海底不同区域位置的环境因子差异。
前人曾通过模拟不同的温度[5-6]、压力[7]、甲烷浓度[8]或营养源[9]等参数条件,探究了不同环境因子条件下气体氧化速率及其对应的微生物群落结构。除此之外,一些实验研究还发现氧浓度也是影响甲烷好氧氧化过程的重要参数之一。首先,从微生物角度而言,氧浓度对甲烷氧化菌的群落结构和活性都存在十分重要的影响。不同甲烷氧化菌具有不同的最适氧浓度范围,其浓度范围差异较大,当氧浓度偏离最适范围时,其微生物活性及甲烷氧化潜力将受到显著抑制。例如Methylosinus trichosporium的最适氧浓度范围较大,跨度为1.6%~18%,而Methylosoma difficile sp. nov.
对氧浓度要求较为苛刻,最适氧浓度仅为2%左右[10]。在极端低氧生境中,大部分氧化菌如Methylococcus和Methylomonas等通常处于休眠状态,仅有Candidatus Methylomirabilis oxyferea等少数氧化菌仍可借助自身的氧转化机制存活,进而发生甲烷氧化反应[1]。其次,从甲烷氧化速率角度而言,氧浓度对甲烷氧化菌的影响将直接导致其甲烷氧化潜力的差异。前人对不同生态系统的实验研究中发现,氧浓度对甲烷氧化速率的影响规律不一。例如,某树叶堆肥低氧培养(1.5%)下甲烷氧化速率高于高氧培养(10.5%)[11],而某稻田土在高氧条件(19.2%)下的氧化速率却显著高于低氧条件(1.1%)[12],推测认为氧浓度对甲烷氧化的影响可能还受其他环境因素的限制。但是,以上实验研究使用的菌群大都来自湖泊、草原、水稻田等环境,指示陆地生态系统规律,海洋和陆地两种不同环境系统的原位微生物组成存在较大不同,两种生境的菌群特性及其甲烷氧化特征可能并不一致[1]。 海水溶解氧主要来源于大气和海洋植物光合作用,受海洋环流、海洋生物、气候以及大陆径流等多重因素影响,海水溶解氧的分布十分复杂[13]。溶解氧具有一定的垂向分布特征,通常由表层海-气界面平衡状态(约200 μmol/L)叠加植物光合作用增长至最高值(约250 μmol/L),随后急剧降低至最小值(约100 μmol/L),进而逐渐随深度回升至表层氧浓度[14-15]。总体来看,海洋生境氧浓度分布虽较为复杂,但是总体呈现低氧的生境特点。海洋低氧生境与低温、高压、高盐等生境特点相耦合的环境背景下,已发现的甲烷氧化菌多以Methylocicrobium属、Methylococcus属、Methylocaldum属、Methylobacter属和Methylocystis属等I 型氧化菌为主[16],它们是海洋生境的优势菌群。Vekemann等[17]曾利用海底沉积物样品实验模拟了不同氧浓度(1%O2和20%O2)的甲烷氧化过程,发现低氧下氧化速率相对较高,但并未从微生物角度分析其中缘由。
氧浓度等环境因子对甲烷好氧氧化影响的相关研究,大多来自于湖泊、草原等陆地生态系统,海洋生境中甲烷好氧氧化研究相对较弱。那么,氧浓度对来自海洋生境的甲烷氧化过程有何影响?氧化菌群落结构、生长繁殖情况及甲烷氧化速率如何表现?为解决以上问题,本文通过室内模拟实验手段,利用来自海底油气泄露区的新鲜沉积物样品作为甲烷氧化菌的菌种来源,模拟不同氧浓度条件下的甲烷好氧氧化过程,分析氧浓度对甲烷氧化菌的群落结构和生长繁殖情况的影响规律,探讨不同氧浓度下的甲烷氧化潜力。
1. 材料与方法
1.1 实验材料
实验菌种来自我国东部渤海湾沙垒田油气渗漏区的表层沉积物(38°16′52.827′′N、118°53′56.893′′W),水深22.7 m。现场测试获得沉积物pH值和氧化还原电位分别为7.57和−29 mV,海底底层溶氧量(DO)年平均值为6.61 mg/L。样品采集方式为遥控潜水式箱形采样器,沉积物重约2.0 kg,避光4 ℃密封贮存。在实验工作前,已通过预培养试验验证了沉积物样品中含有丰富的活性甲烷好氧氧化菌。关于沉积物来源和采集过程的更多细节可详见Li等[8]。
实验所采用的气体包括高纯CH4、O2和N2,纯度均为99.999%。实验中微生物培养液为人工配制海水,配比为NaCl 26.5 g/L,MgCl2 24 g/L,KCl 0.73 g/L,MgSO4 3.3 g/L,NaHCO3 0.2 g/L,CaCl2 1.1 g/L,NaBr 0.28 g/L,pH为7.5。
1.2 实验设计及步骤
根据海洋含氧量特征,本研究将海洋环境分为完全无氧、含微量氧、相对富氧3个氧浓度条件。另外,为了考察海洋来源的甲烷氧化菌在极端富氧环境中的表现,同时考虑甲烷好氧氧化反应的化学计量比,实验还模拟了一种极端富氧条件。因此,实验中共设计4个氧浓度条件:0%O2(实验i)、1%O2(实验ii)、10%O2(实验iii)、50%O2(实验iv),依次对应了完全无氧、含微量氧、相对富氧以及极端富氧的氧浓度条件。其中,实验i(0%O2)体系中,在顶空无氧气供给的基础上,实验还在溶液中额外添加了Na2S试剂,直至氧化还原电位ORP达到约−200 mV以达到完全无氧。实验ii(1%O2)的设定用于模拟海底含微量氧环境,经实验室测定得知,1%O2顶空条件下溶液的氧化还原电位约为−50 mV,其氧浓度条件与渤海与采样位置的原始生存环境(−29 mV)最为接近。实验iii(10%O2)用于模拟海水表层、富氧的南极中层水等相对富氧的氧浓度环境[18]。实验iv(50%O2)中O2含量显著高于大气O2浓度,属于极端富氧环境。各实验分别设置了两个平行实验组。顶空气体中,甲烷分压设定为10%,另外还额外注入高纯氮气作为压力补偿气体,防止后续实验中频繁取气操作造成实验体系真空。根据微需氧微生物培养方法及前期预试验,1%O2与10%O2实验体系需定期补充O2(2 mL/d),使系统内O2浓度保持相对稳定,该补气操作所产生的压力波动较小(<0.002 MPa),可忽略不计。本实验中还设置了一个空白组(50%O2无CH4),在无CH4供应条件下仅充入50% O2,用于观察沉积物中有机质发生完全氧化作用所产生的O2损耗量和CO2产生量。各实验组的具体设定情况详见表1。
表 1 甲烷好氧氧化实验设计方案Table 1. Experimental design for aerobic methane oxidation实验组 O2浓度 底物配比 气体配比 i 0%O2 11 g沉积物+30 mL海水 20 mLCH4+180 mLN2 ii 1%O2 12.7 g沉积物+30 mL海水 20 mLCH4+2 mLO2+178 mLN2 iii 10%O2 11.9 g沉积物+30 mL海水 20 mLCH4+20 mLO2+160 mLN2 iv 50%O2 12.0 g沉积物+30 mL海水 20 mLCH4+100 mLO2+80 mLN2 空白组 50%O2 11.9 g沉积物+30 mL海水 100 mLO2+100 mLN2 实验具体操作步骤如下,每个实验组首先称取约12 g的沉积物样品与30 mL人工海水(V/V接近1/1)进行混匀,注入120 mL玻璃钳口瓶中,随后进行N2洗气操作以除去瓶内空气,丁基橡胶塞密封后用针管连接真空泵进行抽真空处理。按照实验方案分别向各实验组充入实验气体和 N2补充气。另外,我们在实验体系中加入了刃天青显色剂,根据显色程度对实验体系O2浓度情况进行辅助观察。将配制好的8组实验样品分别倒置放于恒温培养摇床中进行恒温避光培养。
1.3 气体组分测定及氧化速率计算
1.3.1 气体组分测定分析
实验过程中定期对顶空气体进行取样及组分测定分析。气体取样间隔为3~7天,由气相色谱配套使用的样品锁定型微量进样针(Hamilton 81056型,100 μL)直接扎取取样,单次取样量50 μL。CH4、CO2的气体组分分析采用即取即测方式,所采用仪器为毛细管分流-氢火焰离子化检测器/热导检测器并联气相色谱仪(GC-FID/TCD,Trace GC Ultra型,Thermo)。色谱柱为HP-PLOT/Q(30 m×0.32 mm×20 μm),载气He(99.999%)。仪器参数为:进样口温度200 ℃,分流比10:1,柱流速3 mL/min,柱箱温度140 ℃(维持4 min)。FID温度280 ℃,氢气、空气、尾吹气流速分别为40、450、40 mL/min。气体测定的相对标准偏差为1.6%~5.0%,方法检出限为0.0003~0.046 mol/mol。依据检测得到的气体百分比例(mol%)、体系压力值、温度值、血清瓶顶空体积等参数代入理想气体状态方程,计算得出CH4、CO2的气体含量(μmol)。
1.3.2 甲烷好氧氧化速率计算
甲烷好氧氧化化学反应方程式:
$$ {\rm{C}}{{\rm{H}}_4} + 2{{\rm{O}}_2} \to {\rm{C}}{{\rm{O}}_2} + 2{{\rm{H}}_2}{\rm{O}} $$ 甲烷好氧氧化速率(methane oxidation rate,MOR)计算公式为:
$$ {\rm{MOR = }}\frac{{{{[{\rm{C}}{{\rm{H}}_{\rm{4}}}]}_{i - t - }}{{[{\rm{C}}{{\rm{H}}_{\rm{4}}}]}_i}}}{{dw \times t}}\;\;\;\left[ {{{\text{ µmol}}}/{\rm{gd}}{{\rm{w/d}}}} \right] $$ 其中,t为本次取样与前一次取样的时间间隔(d),i为本次取样时刻对应的实验天数,[CH4]i为第i天的顶空CH4含量(μmol),[CH4]i-t为前一次取样获得的CH4含量,dw为实验体系中的沉积物干重(g)。以上所采用的MOR计算方法与Wegener 和Boetius[19]类似。经样品烘干称重,计算获得沉积物含水率为17.5%。
1.4 微生物群落分析
1.4.1 沉积物总DNA抽提
对初始样品及不同实验组反应后样品的甲烷好氧氧化菌开展高通量测序和实时荧光定量(qPCR),对比微生物群落组成变化及生长繁殖情况。首先,分别对初始样品及实验开展后的沉积物样品进行取样,取样量为3~5 g。其中实验开展后的沉积物样品由沉积物-培养液的混合泥浆离心获得(9 000 r·min−1,10 min)。沉积物样品保存在−20 ℃待测。
沉积物总DNA抽提采用E.Z.N.A@Soil DNA提取试剂盒(Omega Biotech,美国),抽提步骤按照试剂盒说明书进行。总DNA采用1%琼脂糖凝胶电泳进行检测,使用Nano Drop 2000(Thermo)对DNA纯度及浓度进行检测,−20 ℃保存备用。
1.4.2 微生物高通量测序
利用ABI GeneAmp ® 9700型PCR扩增仪对甲烷好氧氧化菌pmoA功能基因进行PCR扩增,反应体系为20 μL,包括5×FastPfu Bulfer 4 μL,2.5 mM dNTPs 2 μL,上游和下游引物(5 μM)各0.8 μL,FastPfu Polymerase 0.4 μL,Bovine Serum Albumin Solution(BSA)0.2 μL,模板 DNA 10 ng,补ddH2O至20 μL。甲烷氧化菌pmoA功能基因采用引物为189F和mb661[20]。甲烷氧化菌16S rRNA扩增反应条件为:95 ℃变性3 min,40个循环:95 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 45 s,最后72 ℃延伸 10 min。
PCR扩增产物采用AxyPrep DNA凝胶回收试剂盒切胶回收(AXYGEN公司,美国),Tris-HCl洗脱,随后采用2%琼脂糖凝胶电泳进行检测,使用Illumina-Miseq平台(PE300)进行高通量测序分析。使用Uparse软件,在97%的相似水平下对甲烷氧化菌pmoA基因序列进行OTU聚类,选取OTU中出现频数最高的序列作为OTUs代表性核酸序列,将这些核酸序列转化为蛋白序列后,与NCBI数据库进行比对注释,统计各样本在属分类水平上甲烷好氧氧化菌群落组成及相对丰度等信息。本研究所测定的甲烷好氧氧化菌pmoA基因序列的登录号为SRP189409。
1.4.3 微生物qPCR定量
甲烷好氧氧化菌pmoA基因拷贝数由实时荧光定量qPCR测试技术获得(Real-time PCR,博日9600plus型荧光定量PCR仪),pmoA基因qPCR所用引物与PCR扩增引物相同。采用MG96+ PCR仪进行qPCR扩增,反应条件为:95 ℃,5 min;95 ℃,30 s,56 ℃,30 s,72 ℃,1 min,35个循环。扩增结束后用1%琼脂糖凝胶电泳检测扩增结果,将qPCR产物进一步纯化后与质粒载体Pmd18-T连接,蓝白斑筛选法选取阳性克隆提取质粒。以10倍稀释构建好的各质粒(90 μL稀释液+10 μL质粒),通过预实验分别选取标准品的10−2~10−7稀释液用于制备标准曲线。以梯度稀释的16S rRNA基因质粒标准品为模板,进行荧光定量PCR检测。定量PCR试剂为ChamQ SYBR color qPCR Master Mix(2X),反应体系20 μL: 2X ChamQ SYBR Color Qpcr Master Mix 10 μL,上游和下游引物(5 μM)各0.8 μL,模板DNA 2 μL。荧反应条件:95 ℃变性5 min,40个循环:95 ℃变性 5 s,56 ℃退火 30 s,72 ℃延伸 40 s。每个样品设置3个平行,根据标准曲线换算pmoA基因拷贝数。
2. 实验结果
2.1 气体氧化特征
2.1.1 气体组分变化
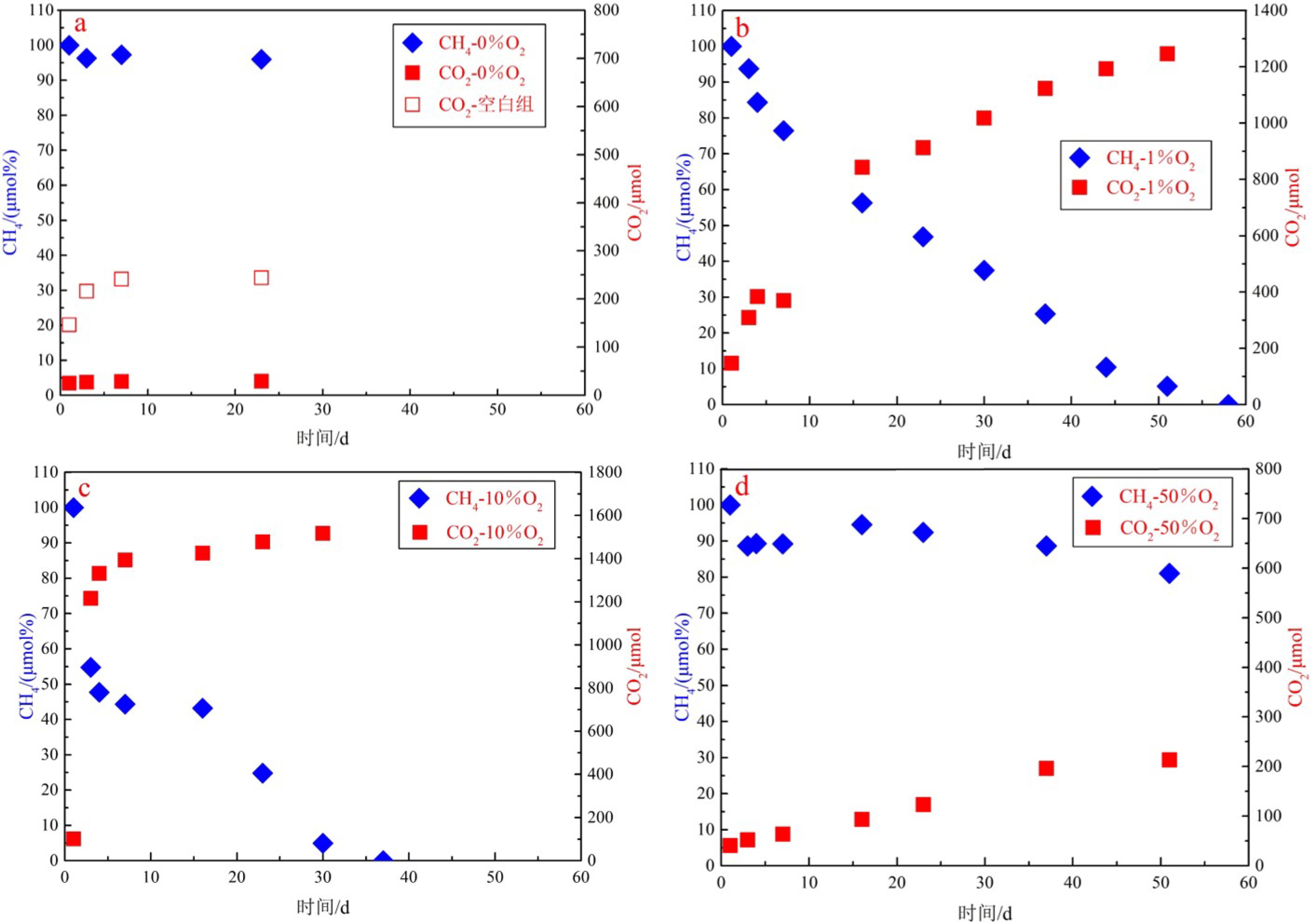
实验测得的顶空CH4(μmol%)和CO2(μmol)的含量数据显示,各平行实验组的数据平行性良好,为方便对比,我们采用各平行实验组的平均值来呈现不同氧浓度下气体含量的变化趋势(图1)。
其中,实验i(0%O2)顶空CH4含量变化较少,CH4含量减少量约为4.0 μmol%,且主要发生在实验前期,后期CH4含量几乎未变化。另外3组实验中CH4含量变化则相对较为明显,且显示出相似的变化趋势,大致可分为两个阶段(图1):初期快速变化阶段,甲烷含量急剧减少,对应了3个甲烷消耗过程的叠加,即CH4的快速溶解、沉积物吸附以及微生物好氧氧化作用;后期平稳变化阶段,甲烷减少幅度趋于平稳,对应了甲烷微生物好氧氧化过程。这一变化趋势在CH4的含量变化速率数据中体现得更为直观(表2),因此,初期快速变化阶段甲烷的消耗速率不能代表甲烷氧化菌所产生的氧化速率,实验中甲烷好氧氧化速率由甲烷含量进入后期平稳变化阶段获得。
表 2 不同氧浓度实验过程中的甲烷氧化速率Table 2. Methane reduction rate from each experiment at different oxygen concentrationsμmol/gdw/d 天数 实验ii-#1(1%O2) 实验ii-#2(1%O2) 实验iii-#1(10%O2) 实验iii-#2(10%O2) 实验iv-#1(50%O2) 实验iv-#2(50%O2) 甲烷含量快速变化阶段 1 — — — — — — 3 6.07 6.65 41.56 31.13 3.80 3.64 4 22.42 15.90 11.59 11.28 — — 甲烷含量平稳变化阶段 4 — — — — 0.35 0.28 7 3.26 7.54 1.52 2.10 0.36 0.20 16 4.40 4.75 0.18 0.24 0.08 0.15 23 3.15 2.36 3.61 4.97 0.21 0.20 30 2.36 3.15 3.96 5.28 — — 37 3.15 3.94 — 2.40 0.24 0.12 44 3.94 4.72 — — — — 51 3.01 2.96 — — 0.44 0.29 MOR平均值* 3.33 4.20 2.32 3.00 0.28 0.21 注:#1和#2分别指的是各实验中的两个平行实验组;MOR平均值*是由甲烷含量处于平稳变化阶段的气体减少速率取平均值获得。 好氧氧化产物CO2含量的增长趋势与CH4百分含量降低趋势相对应(图1),侧面反映了各实验组甲烷的好氧氧化情况。首先,空白组(50%O2无CH4)中所测得CO2的最终产生量为240 μmol,来自于沉积物有机质发生的完全氧化作用,实验组所测得的CO2均由有机质氧化作用与甲烷好氧氧化作用叠加产生。实验组CO2含量结果显示,实验i(0%O2)的CO2增加量较少(29.1 μmol),甚至少于空白组,可见无氧环境下有机质与甲烷的氧化作用微乎其微。其次为实验iv(50%O2),由于CH4未完全氧化,其CO2产生量也相对较少,仅为210 μmol。实验ii(1%O2)与实验iii(10%O2)CH4均完全氧化,其CO2产量相对最多。其中实验iii(10%O2)的CO2产生量最大(1 518 μmol),略高于实验ii(1%O2)的CO2产生量(1 246 μmol),可能是由于实验iii(10%O2)中氧气含量相对充足,有机质氧化作用产生的CO2量偏多。
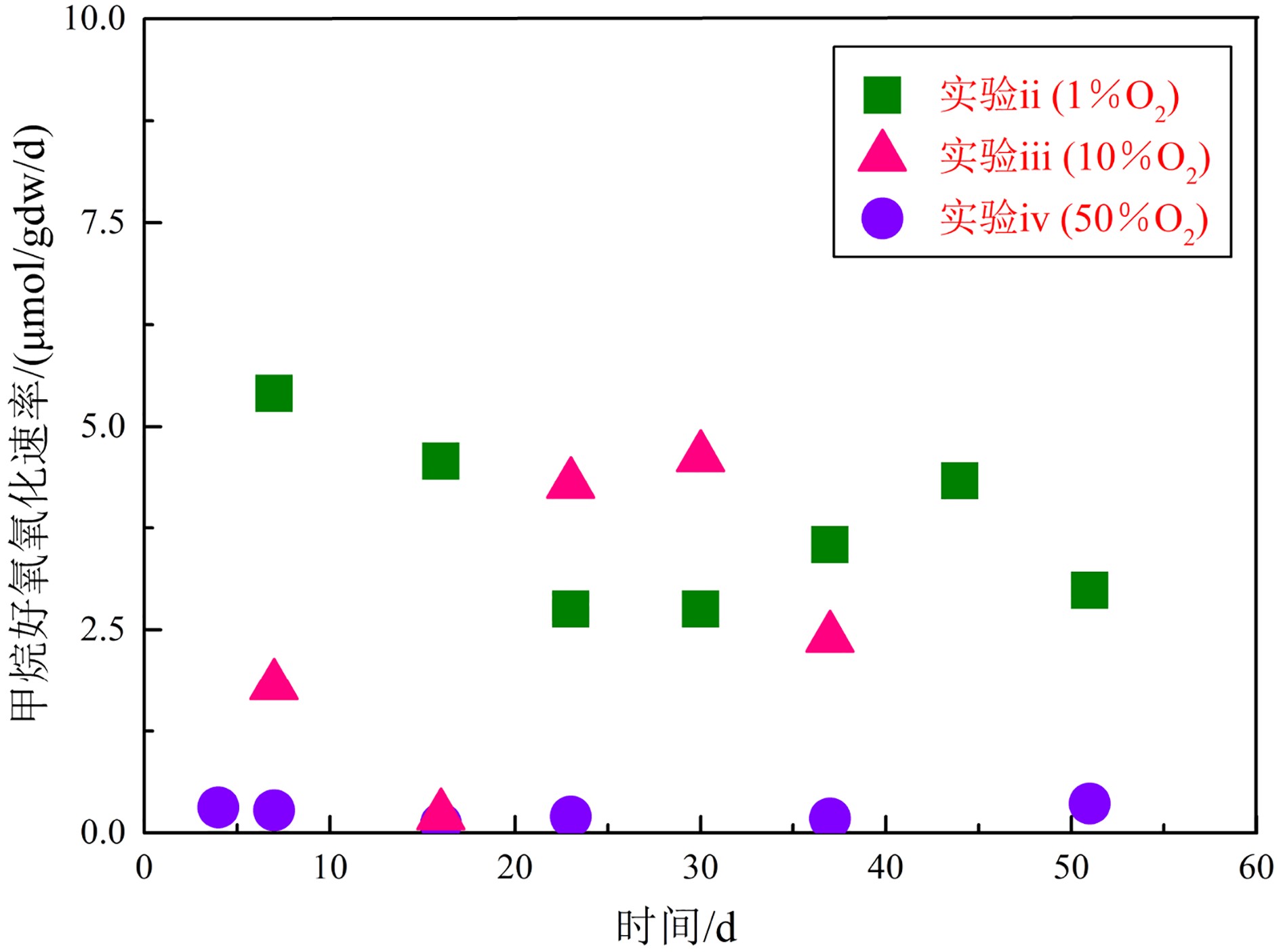
2.1.2 甲烷氧化速率
由甲烷含量进入平稳变化阶段的MOR计算结果显示(表2,图2),不同氧浓度下的平行实验组平行性良好。其中,实验i(0%O2)CH4含量的平稳变化阶段中,CH4含量几乎未变化,MOR可视为零,即未发生微生物好氧氧化过程。实验ii(1%O2)两组平行实验中MOR 在2.36~7.54 μmol/gdw/d范围内,实验iii(10% O2)MOR为0.18~5.28 μmol/gdw/d,实验iv(50% O2)AeOM(CH4)为0.08~0.44 μmol/gdw/d。由此获得实验ii(1%O2)两个平行实验组的平均MOR相对最高,分别为3.33和4.20 μmol/gdw/d,相对而言,实验iii(10%O2)的MOR较低(2.32和3.00 μmol/gdw/d),实验iv(50%O2)的MOR则相对最低,平均值分别为0.20和0.29 μmol/gdw/d。
各实验组的甲烷氧化情况从氧化结束时间上也有所体现。首先,在实验监测期内,实验i(0%O2)和实验iv(50%O2)中CH4均未完全消耗,而实验ii(1%O2)和实验iii(10%O2)中CH4已消耗殆尽。但是,与MOR结果相反,实验iii(10%O2)的CH4完全氧化结束时间最短(37 d),实验ii(1%O2)氧化结束时间为58 d。这是由于实验iii(10%O2)在初期快速变化阶段的CH4减少量(61.5%和46.8%)明显高于实验ii(1%O2)(17.0%和14.2%),使得实验iii(10%O2)在后期氧化阶段实际发生氧化的CH4总量偏少,从而导致实验iii(10%O2)在氧化结束时间上快于实验ii(1%O2)。
2.2 微生物演化特征
2.2.1 甲烷氧化菌群落组成
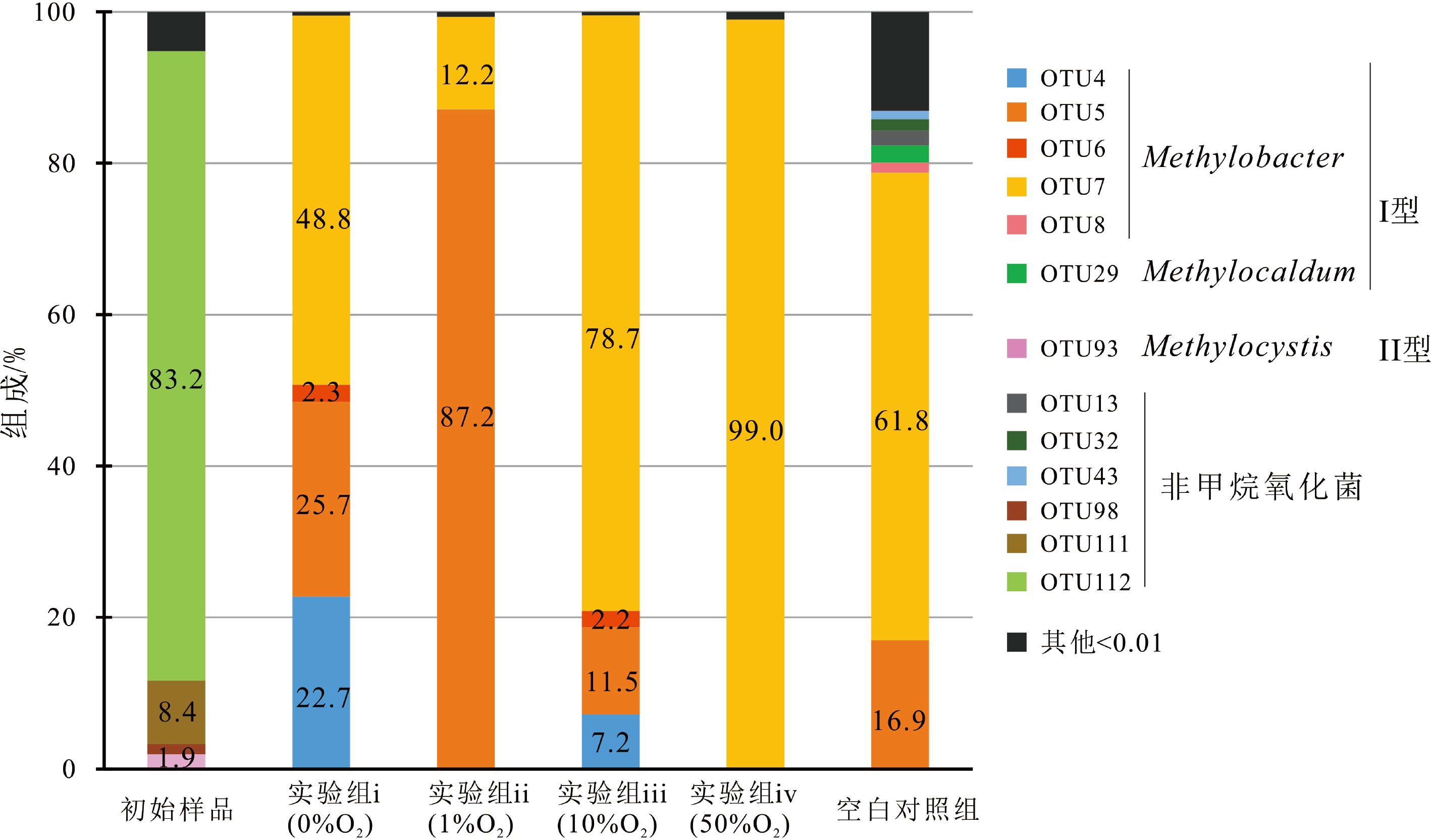
甲烷好氧氧化菌pmoA基因Illumina高通量测序共获得了89 693条高质量序列,以97%相似度划分得到共176个OTUs。α-多样性分析结果显示(表3),各样品文库的覆盖率(Coverage)均高于99.99%,意味着该测序结果包含了大部分的甲烷氧化菌群落,能够体现不同样品中甲烷氧化菌群落的真实情况。其中,Chao1指数与OTU数量对应相等,数据显示,除了空白组(50% O2无CH4)对应样品中OTU数量略高于初始样品外,其余实验组结束后OTU数量(<10)均较实验前明显减少,说明实验i—iv样品中甲烷好氧氧化菌丰度相对较低。Shannon指数结果显示,实验i与空白组样品的Shannon指数(>1)高于初始样品(0.8),而实验ii—iv样品的Shannon指数(<1)却较初始样品变小,反映了实验ii—iv氧化结束后甲烷好氧氧化菌多样性趋于降低的特征。
表 3 甲烷好氧氧化菌pmoA基因α-多样性指数分析Table 3. Analysis of α-diversity index of pmoA gene of methanotrophs样品名称 序列/条 97%相似水平 OTUs Shannon指数 Chao 1指数 覆盖率 初始样品 14023 57 0.8 57 0.9999 实验i(0%O2) 10040 9 1.2 9 1.0000 实验ii(1%O2) 10205 5 0.4 5 1.0000 实验iii(10%O2) 22001 5 0.7 5 1.0000 实验iv(50%O2) 19694 7 0.1 7 0.9999 空白组 13730 93 1.7 93 0.9999 如图3所示,将相对丰度高于1%的13个OTUs的代表序列进行属和种水平的物种注释。本研究中所测得的甲烷氧化菌包括Methylocystis、Methylobacter和Methlocaldum 3种类型,其中Methylocystis隶属于II型甲烷氧化菌(α-Proteobacteria),Methylobacter和Methylocaldum属于I型甲烷氧化菌(γ- Proteobacteria)。初始样品pmoA序列中II型甲烷氧化菌Methlocystis(OTU93)的占比仅为1.9%,其余的则为非甲烷氧化菌(例如Rhodospirillaceae等)或其他在目前数据库中无法注释的序列。甲烷好氧氧化发生后,实验i—iv中所有pmoA序列都一致隶属于I型甲烷氧化菌Methylobacter属,其中实验i(0%O2)中包含了Methylobacter luteus(OTU4、5)和Methylobacter whittenburyi(OTU6、7、8)两个菌种类型,两个类型的所占比例较为接近,分别为48.5%和51.0%。但在实验ii—iv中两种类型的占比优势相差较大,其中实验ii(1%O2)中Methylobacter luteus则为优势菌种,所占比例为87.8%实验iii(10%O2)和实验iv(50%O2)中Methylobacter whittenburyi分别高达80.9%和99.1%。另外,空白组中除了包含Methylobacter之外,还包含Methlocaldum属,与实验组相似的是,Methylobacter属占比相对较高(80.1%),Methlocaldum属含量仅为2.3%。
2.2.2 甲烷氧化菌丰度
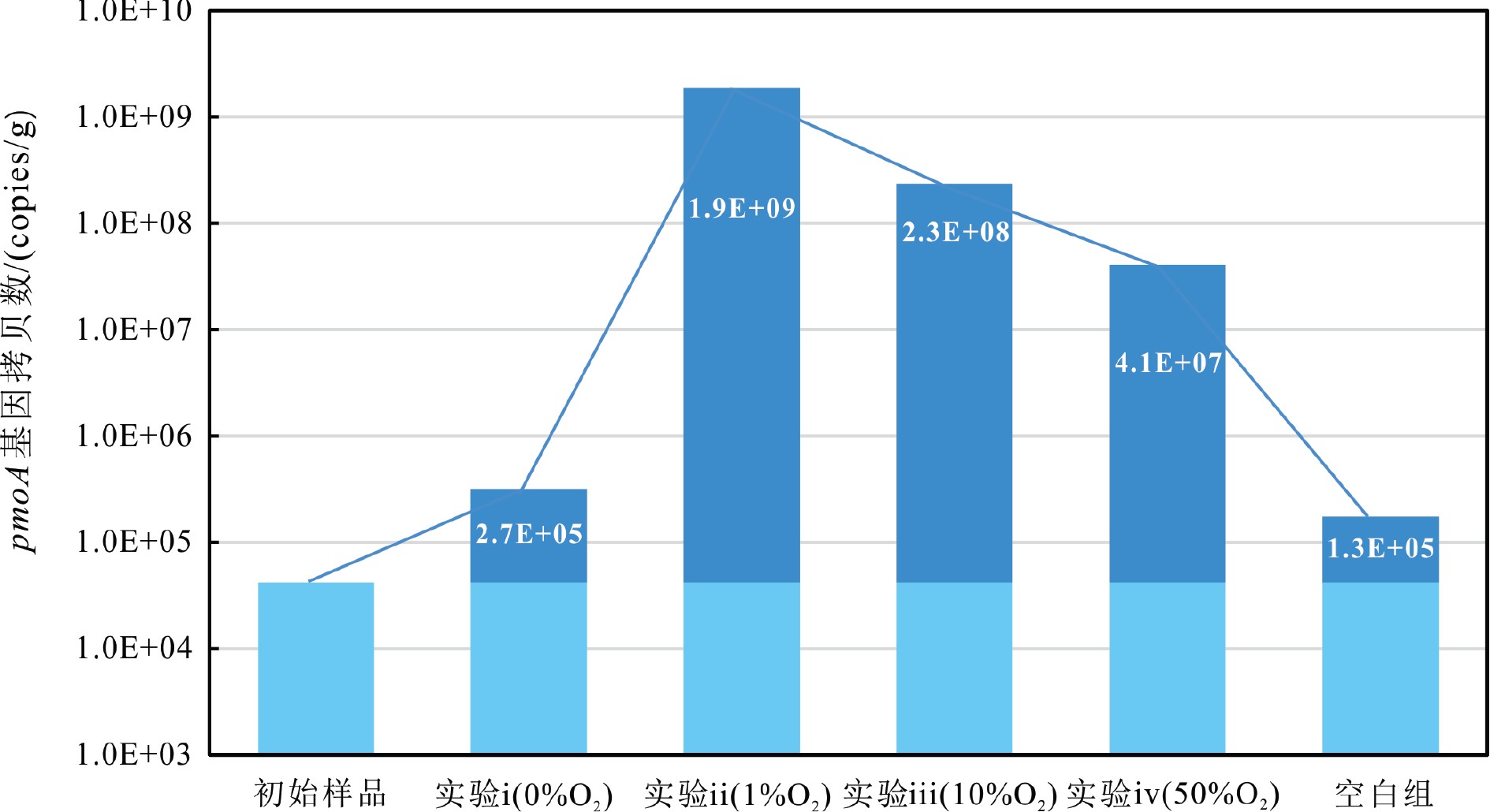
qPCR测定结果显示,每个样品中pmoA基因拷贝数的3个测定结果平行性良好,取其平均值作为甲烷氧化菌总丰度进行下一步数据分析。结果显示,与初始样品相比(4.2×104 copies g−1),实验ii—iv中pmoA基因的丰度呈现出不同程度的增加态势(图4,表4)。其中,实验ii(1% O2)中甲烷氧化菌丰度最高,pmoA基因拷贝数为1.9×109 copies g−1,其次是实验iii(10% O2),其pmoA基因拷贝数为2.3×108 copies g−1,实验iv(50% O2)中pmoA基因拷贝数(4.1×107 copies g−1)较初始样品增长了,3个数量级。另外,实验i(0% O2)与空白组(50% O2无CH4)中pmoA基因拷贝数相近,分别为3.2×105和1.7×105 copies g−1,实验结束后pmoA增长程度十分微弱。
表 4 不同实验组的甲烷氧化菌总丰度、各菌种的绝对丰度#和平均MOR*Table 4. Abundances of methanotrophs, each species# and average MOR*菌群类别 OTU编号 实验i(0%O2) 实验ii(1%O2) 实验iii(10%O2) 实验iv(50%O2) 空白组 甲烷氧化菌总丰度/(copies/g) 所有OTU 3.2×105 1.9×109 2.3×108 4.1×107 1.7×105 methylobacter leteus绝对丰度/(copies/g) OTU4、5 1.5×105 1.7×109 4.4×107 3.1×105 2.9×104 methylobacter whittenburyi绝对丰度/(copies/g) OTU6、7、8 1.6×105 2.3×108 1.9×108 4.0×107 1.1×105 Methylocaldum绝对丰度/(copies/g) OTU29 0 0 0 0 3.9×103 Methylocystis绝对丰度/(copies/g) OTU93 0 0 0 0 0 平均MOR*/(μmol/gdw/d) — — 3.77 2.66 0.25 — 注:平均MOR*是由不同氧浓度实验中两个平行实验组得到的平均氧化速率;菌种的绝对丰度#=甲烷氧化菌总丰度×菌种所占百分比,百分比由高通量测序获得。 3. 讨论
首先,所有实验组i—iv中甲烷氧化菌群落结构均发生了一致性的变化,即氧化实验结束后,样品中甲烷氧化菌的多样性明显降低,表明不同反应条件下均存在具有明显优势的氧化菌菌群,并且优势菌群均由初始样品的II型氧化菌(Methylocystis属)转变为I型氧化菌(Methylobacter属),意味着在本研究的甲烷好氧氧化过程中,II型甲烷氧化菌并不具有甲烷氧化活性,而是由I型甲烷氧化菌从初始休眠状态的极低含量值迅速生长繁殖成为优势氧化菌菌群,这一现象在前人对稻田土好氧-厌氧界面甲烷好氧氧化菌pmoA基因转录组研究中也有相似发现[21],可能与低氧条件下I型甲烷氧化菌的发酵代谢密切相关[10, 22]。
将气体测定结果与微生物数据进行综合分析表明,甲烷氧化速率与甲烷氧化菌生长繁殖情况对应较好,从不同角度反映了各实验组的甲烷氧化情况(表4)。其中,实验i(0%O2)样品与初始样品相比,甲烷组分变化量和甲烷氧化菌pmoA基因丰度数据都显示出较为微弱的变化,但甲烷氧化菌群落结构显示,实验i(0%O2)中甲烷氧化菌的群落组成与其他实验组相似,均由初始样品的II型氧化菌转变为I型氧化菌。在实验i(0%O2)初期,沉积物与无色培养液混合后上清液迅速变为粉色,几天后逐渐恢复无色,这意味着沉积物样品可能本身携带了微量氧,这些微量氧能够为氧化菌提供短暂的复活时间,进而使得实验结束后氧化菌群落结构发生变化。但是由于实验i后续近30 d的实验中顶空甲烷含量始终趋于稳定,且氧化菌pmoA基因丰度(3.2×105 copies/g soil)与空白对照组(1.7×105 copies/g soil)相近,较初始样品(4.2×104 copies/g soil)来说变化十分微弱,因此,我们推测在0%O2无氧体系中并未发生甲烷好氧氧化反应。
将1%O2、10%O2和50%O2实验体系中的MOR和甲烷氧化菌pmoA基因丰度数据对比发现(表4),MOR随氧浓度增加逐渐减弱,MOR(1%O2)与MOR(50%O2)相差近15倍。相应地,甲烷氧化菌丰度亦与氧浓度呈现负相关关系,3个氧浓度梯度下pmoA基因拷贝数均差一个数量级,综合判定表明1%O2体系中甲烷好氧氧化作用最为强烈,其次为10%O2和50%O2体系。甲烷氧化菌群落组成结果表明,在属分类水平上,1%O2、10%O2和50%O2体系氧化菌组成较为一致,均为Methylobacter属,比例分别为99.9%、99.6%和99.9%。但在种分类水平上,3组实验的氧化菌组成差异较大。其中,1%O2体系甲烷氧化菌Methylobacter leteus(OTU4、5)比例(87.8%)明显高于10%O2体系(18.7%),而1%O2体系Methylobacter whittenburyi(OTU6、7、8)比例(12.2%)则明显低于10%O2体系(80.9%),而Methylobacter whittenburyi在50%O2体系下的占比可达99.1%。整体来看,Methylobacter leteus的占比随氧浓度升高逐渐减少,而Methylobacter whittenburyi与之相反,其占比反而随氧浓度升高而增加,显然Methylobacter leteus的变化趋势与MOR较为一致。不同菌种的绝对丰度(表4)对比分析发现,Methylobacter leteus比例虽与氧浓度呈正相关关系,但其绝对丰度随氧浓度增加呈现出明显降低趋势,这是由于3个氧浓度体系中氧化菌总丰度不同所导致的。经前人验证,在各样本间进行微生物数据对比分析时,尤其是微生物总丰度相差较大的情况下,需将测序与定量结果相结合,估算并采用各菌种的绝对丰度进行分析[23-24]。由此看来,与Methylobacter leteus相同,Methylobacter whittenburyi的生长繁殖情况与不同氧浓度下MOR的变化趋势也是一致的。综上所述,MOR和甲烷氧化菌的生长繁殖情况将随氧浓度增加呈现明显降低趋势,氧浓度越高,氧化菌生长繁殖越慢,所产生的甲烷氧化作用愈为微弱。
从各实验体系中甲烷氧化菌群落组成特征分析发现,海洋生境中的甲烷好氧氧化作用对氧浓度的响应特征可能具有某些特殊性。本实验中不同氧浓度体系下Methylobacter leteus是主要的优势菌群,甲烷氧化作用在不同氧浓度下的表现与Methylobacter leteus生理生态特征的关系最为紧密。前人曾报道低氧生境常见甲烷氧化菌之一Methylobacter leteus的最适氧浓度区间为5%~20%,其氧化活性将随氧浓度的降低受到明显的抑制[10]。然而,本次研究中Methylobacter leteus则表现不同,在1%O2微量氧条件下的菌落活性明显优于10%O2和50%O2富氧环境条件,而1%O2氧浓度体系与样品取样位置的原位氧浓度环境最为接近,这意味着来自海洋低氧生境的Methylobacter leteus在与原位生境接近的微量氧条件下发挥出相对较大的甲烷氧化活性。这可能是由于在海底低氧叠加高盐、低温、高压等特殊海洋生境的长期驯化下[25],Methylobacter leteus可能表现出不同的生理生态特征,从而导致并未在其最适氧浓度范围内表现出最佳氧化活性。但需要注明的是,实验可能存在实施时间或实施量的尺度问题,如果在给定条件下实施更为长期的氧化实验对甲烷氧化菌进行驯化,那么实验给定条件可能将成为下一个所谓的“原始生境”。同时,在50%O2较高氧浓度条件下氧化作用较为微弱的原因还可能是充足的氧供给使得甲烷氧化过程的中间产物或代谢产物(例如甲醇、甲醛等)浓度过高,以致具有“毒性”,从而抑制了甲烷氧化菌的生长繁殖[17]。此外,前人曾提到氧浓度对MOR的影响是非常复杂的,可能受到营养源浓度、甲烷浓度等其他环境因子的影响[12, 26],但本次实验中并未涉及这些变量,在对于海洋生境甲烷好氧氧化作用的进一步研究中应加强这方面的实验工作。
4. 结论
(1)完全无氧条件(0%O2)中不能发生甲烷好氧氧化作用,甲烷氧化速率及甲烷氧化菌总丰度随氧浓度升高而降低,当氧浓度由1%升高至50%时,甲烷氧化速率减弱了约15倍,甲烷氧化菌总丰度降低了两个数量级。
(2)甲烷氧化菌优势菌种为I型氧化菌Methylobacter leteus和Methylobacter whittenburyi。氧浓度由1%升高至50%时,Methylobacter leteus的占比由87.8%降低为0.8%,Methylobacter whittenburyi则相反,从18.7%升至99.1%。但两者的绝对数量均随着氧浓度增加呈现出不同程度的降低态势。
(3)本实验中甲烷好氧氧化作用的最适氧浓度条件为1%O2体系,该条件与采样位置的原始生存环境最为接近,但与优势氧化菌Methylobacter属的已知最适氧浓度(5%~20%)并不一致。原因可能是在海底低氧条件叠加低温、高压等特殊生境的长期驯化下,甲烷氧化菌的最适氧浓度条件将发生变化,逐渐趋于其原始生存环境。
-
表 1 甲烷好氧氧化实验设计方案
Table 1 Experimental design for aerobic methane oxidation
实验组 O2浓度 底物配比 气体配比 i 0%O2 11 g沉积物+30 mL海水 20 mLCH4+180 mLN2 ii 1%O2 12.7 g沉积物+30 mL海水 20 mLCH4+2 mLO2+178 mLN2 iii 10%O2 11.9 g沉积物+30 mL海水 20 mLCH4+20 mLO2+160 mLN2 iv 50%O2 12.0 g沉积物+30 mL海水 20 mLCH4+100 mLO2+80 mLN2 空白组 50%O2 11.9 g沉积物+30 mL海水 100 mLO2+100 mLN2 表 2 不同氧浓度实验过程中的甲烷氧化速率
Table 2 Methane reduction rate from each experiment at different oxygen concentrations
μmol/gdw/d 天数 实验ii-#1(1%O2) 实验ii-#2(1%O2) 实验iii-#1(10%O2) 实验iii-#2(10%O2) 实验iv-#1(50%O2) 实验iv-#2(50%O2) 甲烷含量快速变化阶段 1 — — — — — — 3 6.07 6.65 41.56 31.13 3.80 3.64 4 22.42 15.90 11.59 11.28 — — 甲烷含量平稳变化阶段 4 — — — — 0.35 0.28 7 3.26 7.54 1.52 2.10 0.36 0.20 16 4.40 4.75 0.18 0.24 0.08 0.15 23 3.15 2.36 3.61 4.97 0.21 0.20 30 2.36 3.15 3.96 5.28 — — 37 3.15 3.94 — 2.40 0.24 0.12 44 3.94 4.72 — — — — 51 3.01 2.96 — — 0.44 0.29 MOR平均值* 3.33 4.20 2.32 3.00 0.28 0.21 注:#1和#2分别指的是各实验中的两个平行实验组;MOR平均值*是由甲烷含量处于平稳变化阶段的气体减少速率取平均值获得。 表 3 甲烷好氧氧化菌pmoA基因α-多样性指数分析
Table 3 Analysis of α-diversity index of pmoA gene of methanotrophs
样品名称 序列/条 97%相似水平 OTUs Shannon指数 Chao 1指数 覆盖率 初始样品 14023 57 0.8 57 0.9999 实验i(0%O2) 10040 9 1.2 9 1.0000 实验ii(1%O2) 10205 5 0.4 5 1.0000 实验iii(10%O2) 22001 5 0.7 5 1.0000 实验iv(50%O2) 19694 7 0.1 7 0.9999 空白组 13730 93 1.7 93 0.9999 表 4 不同实验组的甲烷氧化菌总丰度、各菌种的绝对丰度#和平均MOR*
Table 4 Abundances of methanotrophs, each species# and average MOR*
菌群类别 OTU编号 实验i(0%O2) 实验ii(1%O2) 实验iii(10%O2) 实验iv(50%O2) 空白组 甲烷氧化菌总丰度/(copies/g) 所有OTU 3.2×105 1.9×109 2.3×108 4.1×107 1.7×105 methylobacter leteus绝对丰度/(copies/g) OTU4、5 1.5×105 1.7×109 4.4×107 3.1×105 2.9×104 methylobacter whittenburyi绝对丰度/(copies/g) OTU6、7、8 1.6×105 2.3×108 1.9×108 4.0×107 1.1×105 Methylocaldum绝对丰度/(copies/g) OTU29 0 0 0 0 3.9×103 Methylocystis绝对丰度/(copies/g) OTU93 0 0 0 0 0 平均MOR*/(μmol/gdw/d) — — 3.77 2.66 0.25 — 注:平均MOR*是由不同氧浓度实验中两个平行实验组得到的平均氧化速率;菌种的绝对丰度#=甲烷氧化菌总丰度×菌种所占百分比,百分比由高通量测序获得。 -
[1] Ul Haque M F, Xu H J, Murrell J C, et al. Facultative methanotrophs-diversity, genetics, molecular ecology and biotechnological potential: a mini-review [J]. Microbiology, 2020, 166(10): 894-908. doi: 10.1099/mic.0.000977
[2] Boetius A, Wenzhöfer F. Seafloor oxygen consumption fuelled by methane from cold seeps [J]. Nature Geoscience, 2013, 6(9): 725-734. doi: 10.1038/ngeo1926
[3] Crespo-Medina M, Meile C D, Hunter K S, et al. The rise and fall of methanotrophy following a deepwater oil-well blowout [J]. Nature Geoscience, 2014, 7(6): 423-427. doi: 10.1038/ngeo2156
[4] Leonte M, Kessler J D, Kellermann M Y, et al. Rapid rates of aerobic methane oxidation at the feather edge of gas hydrate stability in the waters of Hudson Canyon, US Atlantic Margin [J]. Geochimica et Cosmochimica Acta, 2017, 204: 375-387. doi: 10.1016/j.gca.2017.01.009
[5] Han J S, Mahanty B, Yoon S U, et al. Activity of a methanotrophic consortium isolated from landfill cover soil: response to temperature, pH, CO2, and porous adsorbent [J]. Geomicrobiology Journal, 2016, 33(10): 878-885. doi: 10.1080/01490451.2015.1123330
[6] Oshkin I Y, Belova S E, Danilova O V, et al. Methylovulum psychrotolerans sp. nov., a cold-adapted methanotroph from low-temperature terrestrial environments, and emended description of the genus Methylovulum [J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(6): 2417-2423. doi: 10.1099/ijsem.0.001046
[7] 张瑞林, 任学清. 不同压力及氧环境条件下微生物降解煤层瓦斯实验研究[J]. 煤矿安全, 2014, 45(11):1-4 ZHANG Ruilin, REN Xueqing. Experimental study on coal seam gas degradation by microorganism under different pressure and oxygen environment conditions [J]. Safety in Coal Mines, 2014, 45(11): 1-4.
[8] Li J, Liu C L, He X L, et al. Aerobic microbial oxidation of hydrocarbon gases: Implications for oil and gas exploration [J]. Marine and Petroleum Geology, 2019, 103: 76-86. doi: 10.1016/j.marpetgeo.2019.02.013
[9] Karthikeyan O P, Chidambarampadmavathy K, Nadarajan S, et al. Influence of nutrients on oxidation of low level methane by mixed methanotrophic consortia [J]. Environmental Science and Pollution Research, 2016, 23(5): 4346-4357. doi: 10.1007/s11356-016-6174-7
[10] 马若潺, 魏晓梦, 何若. 低氧生境中好氧甲烷氧化菌的缺氧耐受机理及种群结构研究进展[J]. 应用生态学报, 2017, 28(6):2047-2054 MA Ruochan, WEI Xiaomeng, HE Ruo. Mechanism of hypoxia-tolerance and community structure of aerobic methanotrophs in O2-limited environments: A review [J]. Chinese Journal of Applied Ecology, 2017, 28(6): 2047-2054.
[11] Wilshusen J H, Hettiaratchi J P A, De Visscher A, et al. Methane oxidation and formation of EPS in compost: effect of oxygen concentration [J]. Environmental Pollution, 2004, 129(2): 305-314. doi: 10.1016/j.envpol.2003.10.015
[12] Henckel T, Roslev P, Conrad R. Effects of O2 and CH4 on presence and activity of the indigenous methanotrophic community in rice field soil [J]. Environmental Microbiology, 2000, 2(6): 666-679. doi: 10.1046/j.1462-2920.2000.00149.x
[13] Schmidtko S, Stramma L, Visbeck M. Decline in global oceanic oxygen content during the past five decades [J]. Nature, 2017, 542(7641): 335-339. doi: 10.1038/nature21399
[14] Valentine D L, Kessler J D, Redmond M C, et al. Propane respiration jump-starts microbial response to a deep oil spill [J]. Science, 2010, 330(6001): 208-211. doi: 10.1126/science.1196830
[15] Kessler J D, Valentine D L, Redmond M C, et al. A persistent oxygen anomaly reveals the fate of spilled methane in the Deep Gulf of Mexico [J]. Science, 2011, 331(6015): 311-315.
[16] Okita N, Hoaki T, Suzuki S, et al. Characteristics of aerobic methane-oxidising bacterial community at the sea-floor surface of the Nankai Trough [J]. Marine and Freshwater Research, 2020, 71(10): 1252-1258. doi: 10.1071/MF19317
[17] Vekeman B, Dumolin C, De Vos P, et al. Improved enrichment culture technique for methane-oxidizing bacteria from marine ecosystems: the effect of adhesion material and gas composition [J]. Antonie van Leeuwenhoek, 2017, 110(2): 281-289. doi: 10.1007/s10482-016-0787-1
[18] Llanillo P J, Karstensen J, Pelegrí J L, et al. Physical and biogeochemical forcing of oxygen and nitrate changes during El Niño/El Viejo and La Niña/La Vieja upper-ocean phases in the tropical eastern South Pacific along 86° W [J]. Biogeosciences, 2013, 10(10): 6339-6355. doi: 10.5194/bg-10-6339-2013
[19] Wegener G, Boetius A. An experimental study on short-term changes in the anaerobic oxidation of methane in response to varying methane and sulfate fluxes [J]. Biogeosciences, 2009, 6(5): 867-876. doi: 10.5194/bg-6-867-2009
[20] Barbier B A, Dziduch I, Liebner S, et al. Methane-cycling communities in a permafrost-affected soil on Herschel Island, Western Canadian Arctic: active layer profiling of mcrA and pmoA genes [J]. FEMS Microbiology Ecology, 2012, 82(2): 287-302. doi: 10.1111/j.1574-6941.2012.01332.x
[21] Reim A, Lüke C, Krause S, et al. One millimetre makes the difference: high-resolution analysis of methane-oxidizing bacteria and their specific activity at the oxic–anoxic interface in a flooded paddy soil [J]. The ISME Journal, 2012, 6(11): 2128-2139. doi: 10.1038/ismej.2012.57
[22] Kalyuzhnaya M G, Yang S, Rozova O N, et al. Highly efficient methane biocatalysis revealed in a methanotrophic bacterium [J]. Nature Communications, 2013, 4(1): 2785. doi: 10.1038/ncomms3785
[23] Dannemiller K C, Lang-Yona N, Yamamoto N, et al. Combining real-time pcr and next-generation dna sequencing to provide quantitative comparisons of fungal aerosol populations [J]. Atmospheric Environment, 2014, 84: 113-121. doi: 10.1016/j.atmosenv.2013.11.036
[24] Zhang Z J, Qu Y Y, Li S Z, et al. Soil bacterial quantification approaches coupling with relative abundances reflecting the changes of taxa [J]. Scientific Reports, 2017, 7(1): 4837. doi: 10.1038/s41598-017-05260-w
[25] Bowman J P. Methylobacter[M]//Whitman W B. Bergey's Manual of Systematics of Archaea and Bacteria. John Wiley & Sons, Inc., 2015: 1-9.
[26] Bussmann I, Rahalkar M, Schink B. Cultivation of methanotrophic bacteria in opposing gradients of methane and oxygen [J]. FEMS Microbiology Ecology, 2006, 56(3): 331-344. doi: 10.1111/j.1574-6941.2006.00076.x
-
期刊类型引用(1)
1. 李云海,林云鹏,王亮,龙邹霞,郑斌鑫. 台风“莫拉克”(2009)对浙闽沿岸泥质中心沉积有机质组成与分布的影响. 海洋地质与第四纪地质. 2024(05): 27-37 .  本站查看
本站查看
其他类型引用(0)



 下载:
下载: