Geochemical records of biological carriers on deepsea hydrothermal vent and methane seep fields
-
摘要: 海底冷泉-热液极端环境是岩石圈与外部圈层进行物质交换和能量流动的主要窗口,其独特的地质条件和营养模式孕育了繁茂的生物群落和生态系统。由于多种因素的叠加控制,海底极端环境的理化性质通常变化频繁且剧烈。大量研究表明,这种变化或波动又能不同程度地被环境中生存的生物记录下来,因此,生物所保留下来的某些地球化学信息具有恢复重建其生存环境变化的潜在能力,这对人类目前尚难自由出入的深海极端环境的探索尤为重要。本文从海底极端环境生物种类和空间分布、生物壳体的地球化学信息、生物元素和同位素地球化学指标以及生物有机生标等几方面出发,探讨当前科学家关注的典型地球化学指标对沉积环境的记录应用,并展望了未来需要进一步加强研究的几个方面,希望借此能引起广大研究者对该领域的兴趣和重视,以加深加快对海底极端环境内运行规律和影响的认识。Abstract: The environments of cold seep and hydrothermal vent are the main windows for material exchange and energy flow between lithosphere and outer spheres, and their unique geological conditions and nutrient patterns give birth to the lush biological communities and ecosystems. The change of physical and chemical properties of extreme environment will affect the geochemical information carried by the organisms living in extreme environment, so the extreme environment organisms could be used as a effective proxy for environmental recovery. In this paper, attempt is made to address the concerned geochemical information with emphases on biological species, spatial distribution pattern, mineral geochemistry of biocarrier rocks, geochemical indicators of biological elements and isotopes, and lipid biomarker in paleoenvironmental reconstruction. The application of the information to the restoration of sedimentary environments is discussed, in addition to future research directions. We hope that the introduction may raise interests and attentions from researchers.
-
Keywords:
- hydrothermal vent /
- cold seeps /
- biological carriers /
- geochemical records /
- isotopic records /
- organic biomarkers
-
稀土元素对新型电子设备和新能源技术的发展至关重要,也是很多国家改造传统产业,发展高新技术和国防尖端技术不可或缺的战略资源。我国是稀土原材料的主要加工地(约85%),同时也是世界最大的稀土氧化物消费国 [1]。当前,受全球绿色能源转型的推动,未来清洁能源技术相关的需求可能会进一步增长。由于这样巨大的需求前景和潜在的供应链风险,近年来很多国家开始寻求新的稀土矿产资源[2]。日本学者Kato等在2011年报道了在南太平洋东部和北太平洋中部广泛分布着具有高稀土含量的深海沉积物,其中深海泥中总稀土含量可高达1000~2230 μg/g,其稀土含量与我国华南离子吸附型矿床相当或更高[3],这一报道引发了国内外学者对深海富稀土沉积物研究的热情。
在自然界,稀土矿物被发现存在于内生和表生或次生矿床中。内生矿床指在地壳中通过岩浆-热液过程形成的矿床[4],而表生或次生矿床则通过风化和沉积过程在地表形成[5];前者主要包括碳酸岩、碱性岩和热液型矿床,后者主要为离子吸附型、砂矿和海底沉积型矿床[6-7]。有学者研究发现,我国华南离子吸附型稀土矿床中稀土元素的富集主要受铁氧化物-黏土矿物复合体的共同约束[8]。而对于海底沉积物型的稀土矿物的形成过程,近些年的研究也取得了一些进展[9-11]。印度洋海盆的沉积物中有非常高的稀土含量, 稀土元素的组成和太平洋接近,其来源主要受到陆源物质和火山物质影响,推测稀土元素可能是吸附在其他物质沉积后再向磷灰石富集[12-13]。东太平洋CC区多个富稀土站位沉积物均以沸石黏土为主,西太平洋深海底泥中稀土元素的主要赋存矿物为磷酸盐矿物,包括磷灰石、独居石和磷钇矿等[14-15]。然而随着研究的深入,研究者发现在各种矿物的形成过程中也包含了微生物驱动的生物矿化的过程,矿物-微生物相互作用在环境变化、元素生物地球化学循环和矿床形成中起着重要作用[16]。微生物广泛分布于各种海洋地质环境中,它们参与了从地球表面到地下深部岩石圈中很多的地质地球化学过程[17]。研究发现海洋微生物是海底沉积作用和成矿作用的主要参与者和作用者,微生物不仅能催化成矿元素富集、沉淀直接成矿,而且还可以改变介质的酸碱条件促使成矿元素沉淀聚集而间接成矿[18-20]。深海矿物的形成也包含了微生物(生物矿化)驱动的生物过程。例如在富稀土的大洋多金属结核中发现的颗石藻化石以及生物膜的印记[21],还有研究发现海洋细菌在产生氧化表面的沉积物中起关键作用[22]。
海洋沉积物中微生物多样性的分析提示了微生物参与了海洋地质环境的形成过程[23-26]。海洋微生物在稀土矿产资源形成过程中发挥的作用以及稀土元素的海洋微生物成矿过程尚不明确。为了探讨这些问题,我们选取了从深海沉积物中成功分离培养的几种细菌,开展了海洋细菌对稀土元素富集和矿化过程的研究,期待能为大洋中稀土矿产资源的生物成因过程提供一些理论依据,具有十分重要的学术意义和实际意义。
1. 材料与方法
通过收集整理前期已经成功从沉积物样品(东海大陆架CW126/冲绳海槽CW27)中分离纯化的200 余株单克隆菌落,通过比较微生物的分布规律、数量及种类,初步筛选出3种海洋细菌进行实验室稀土元素铈(Ce)的吸附富集模拟实验。沉积物样品的采样站位图如图1所示。从冲绳海槽表层沉积物(表层4 cm, 水深1 193 m)中分离培养出Paenisporosarcina sp. CW27-A08(芽孢八叠球菌),从东海大陆架表层沉积物(表层1 cm, 水深81.13 m)中分离培养出Jeotgalibacillus sp. CW126-A03(咸海鲜芽孢杆菌)和Sulfitobacter sp. CW126-B11(亚硫酸杆菌)。菌株CW27-A08为革兰氏阳性菌, 呈椭圆或杆状, 大小约1.0~2.0 μm, 菌株16s RNA 基因序列为GenBank No.KP307800。菌株CW126-A03为革兰氏阳性菌,呈椭圆或杆状,大小约1.5~2.0 μm,菌株16s RNA 基因序列为GenBank No.MT845653。菌株CW126-B11为革兰氏阴性菌,呈杆状,大小约0.5~1.5 μm,菌株16s RNA 基因序列为GenBank No.KP307833。将冻存于–80 ℃冰箱中的菌种活化后接种到2216E液体培养基中, 在25 ℃摇床120 r/min下培养1天后备用。2216E培养基组成为:过滤后的天然海水,5 g/L蛋白胨,1 g/L酵母提取物,混合后pH调节至7.25。
实验室模拟不同海洋细菌对稀土元素Ce的吸附富集实验,实验中设置不同浓度Ce的反应体系,反应温度为4 ℃,反应时间0~2个月。反应过程中在不同的时间点间隔取样, 测定反应体系中稀土Ce离子浓度的变化和pH 值的变化,并通过扫描电镜(SEM-scanning electron microscope)和透射电镜(TEM-transmission electron microscope)及能谱仪(EDS-energy dispersive spectrometer)观察不同反应时间细菌表面稀土元素Ce形态的变化情况。反应体系采用人工海水(24.32 g/L NaCl, 10.98 g/L MgCl2·6H2O, 4.06 g/L Na2SO4, 0.20 g/L NaHCO3, 0.027 g/L H3BO3, 0.10 g/L KBr, 0.69 g/L KCl, 1.14 g/L CaCl2), pH为7.8。实验实施过程中测定反应体系中细菌密度的方法为:将已知体积的菌液离心后(6000 rpm),去掉上清液,放入冰箱冷冻后进行低压冷冻干燥,称量菌体的干重。反应中所用的溶液和实验器材都经过灭菌处理,实验在无菌操作台中进行。
采用电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS, Thermo Fisher 公司, ICAPQC)测定反应体系中的稀土元素Ce和P的离子浓度。在不同反应时间点取样,离心后吸取上清液,并用0.22 μm聚四氟乙烯滤膜过滤后制成测试样品,测定元素浓度。运用扫描电镜(SEM, Hitachi, S-4800型)分析测定模拟实验中细菌表面形态的变化。取反应液4 000 r/min 离心10 min 后去除上清液, 用超纯水反复清洗菌液3 遍后, 吸取少量菌液滴到硅片上, 烘干后固定于电镜样品台上,进行扫描电镜观察, 工作电压15 kV。采用透射电镜(TEM, 荷兰飞利浦公司, CM12/STEM)考察相互作用过程中微生物表面形成的矿物形态。取反应液在4 000 r/min离心10 min 后去除上清液, 用超纯水反复清洗菌液3遍, 重悬后吸取少量菌液滴到铜网上, 待干燥后进行观察。工作电压为120 kV,点分辨率0.34 nm,配备电子衍射分析系统和能谱分析系统。
2. 结果与讨论
2.1 不同海洋细菌对稀土元素Ce的吸附富集过程
已经成功分离培养并筛选出的成矿微生物菌株CW126-A03(标记为A03)、菌株CW27-A08(标记A08)、菌株CW126-B11(标记为B11)的SEM图展示了3种海洋细菌的形貌特征(图2)。3种海洋细菌均呈现椭圆状或杆状,大小约0.5~2.0 μm。通过观察三种细菌接种后的生长周期,均在12~24 h处于对数生长期,此时细胞数量迅速增长,代谢活动旺盛,适宜进行接种实验。在24 h后,生长速率逐渐降低,细菌生长进入稳定期。
在设定4℃人工海水的环境下,分别考察了3种不同海洋细菌对Ce的吸附富集过程。利用ICP-MS测定不同反应时间下(0~2个月)元素Ce、P浓度的变化,并检测反应过程中pH值的变化,分析海洋细菌吸附稀土元素的化学动力学过程。图3显示了不同海洋细菌对稀土元素Ce吸附的时间曲线,其中Ce的初始浓度均为1.4 μg/g,反应体系中菌株CW126-A03、菌株CW27-A08、菌株CW126-B11的细菌干密度分别为0.26 、0.12、0.10 g/L。Ce的吸附率为反应溶液中Ce离子浓度降低值占Ce初始浓度值的百分比数。随着反应时间的增长,溶液中Ce浓度相对于初始Ce浓度的降低,反映了稀土Ce被海洋细菌吸附富集的过程。结果显示3种不同的海洋细菌对稀土元素都有富集作用,反应体系中稀土元素的浓度随着反应时间的增长而逐渐降低,稀土元素Ce的累计吸附率随时间增长而逐渐增大。从吸附曲线上可以看出,海洋细菌对Ce初期的吸附速率较快,3种细菌初始的吸附率均达到60%以上,并在反应2周后达到95%以上。菌株CW126-B11相对于CW126-A03和CW27-A08对稀土Ce有较快的吸附效率。
图4显示了3种不同海洋细菌吸附富集稀土Ce的过程中反应体系中P元素浓度的变化趋势大概相似。随着反应时间的增长体系中P的浓度都呈现先快速降低,随后保持低浓度一段时间,然后再升高的一个过程。说明海洋细菌在吸附富集稀土Ce的过程中,大致可以分为3个阶段。在起初的24 h内,带正电荷Ce3+被快速地吸附在细胞表面,与细胞表面带负电荷的官能团(尤其以磷酸盐官能团为主)形成络合物,从而消耗了初始溶液中细菌代谢产生的P[27]。随着稀土Ce被细菌富集完成,溶液中的P浓度被消耗从而保持在低浓度状态。然而随着反应时间的增长,溶液中细菌的活性减弱,细胞壁可能会破裂,从而导致P从细胞中逐渐被释放出来,因而反应体系中的P浓度又会增高。反应初期溶液中P浓度的降低和Ce的迅速被吸附相对应,表明海洋细菌对稀土Ce有一个快速细胞表面吸附的过程。这个现象与之前发现的真菌和细菌对稀土的吸附过程相似[28]。研究发现不同海洋细菌的反应体系中,反应过程中pH的变化范围相似(在7.3~7.8之间)(图5),反应初期稍有波动,后期相对较稳定。
2.2 海洋细菌对稀土元素Ce吸附富集的影响因素
图3展示了不同的海洋细菌对稀土元素的吸附速率也有所不同,在相同Ce初始浓度的反应体系中,菌密度较低的革兰氏阴性菌CW126-B11依然比菌密度高的革兰氏阳性菌CW126-A03和CW27-A08吸附富集稀土Ce的效率稍高,初步推断这与微生物自身的组成结构及细胞表面的结构特征有关[29]。此外,通过研究同种海洋细菌CW126-A03对稀土元素Ce在不同初始浓度条件下的吸附过程,来进一步考察海洋细菌吸附富集Ce的影响因素。实验中设置了3个反应体系,分别为Ce初始浓度为0.14 ug/g时CW126-A03菌干密度为0.36 g/L;Ce初始浓度为1.4 μg/g时细菌干密度为0.26 g/L;Ce初始浓度为14 μg/g时细菌干密度为0.36 g/L。图6显示了CW126-A03对Ce在7天内的短期吸附过程,细菌密度较大反应体系中(0.14 μg/g和14 μg/g)对稀土Ce的吸附速率较快。在相同菌密度条件下,稀土Ce初始浓度较低的体系(0.14 μg/g)中细菌的吸附速率在前4天相对稍快一些。
图7显示了CW126-A03对Ce在45天内的相对较长期吸附过程,3种不同体系中反应初期14天内的吸附速率各有不同,随着反应时间增长,14天后海洋细菌对稀土Ce的富集率都达到98%以上。这些实验结果表明海洋细菌吸附富集稀土元素的效率主要与细菌密度和稀土元素浓度有关,在相同的元素浓度条件下,菌密度越高短期的吸附速率越快。而随着吸附富集时间的增长,细菌活性降低及代谢产物的增加,可能会诱导稀土元素完成更多的富集和沉淀。综上所述,细菌种类以及细菌密度与被吸附元素浓度的比例关系,是影响海洋细菌富集稀土元素的主要影响因素。前期有研究表明,不同微生物细胞壁的结构特征不同,细胞表面的吸附位点(官能团)数量也不同,因而对金属阳离子的吸附能力也有差异[30-32]。
结果显示3种细菌对Ce均有吸附富集作用,在几个不同的反应体系中,海洋细菌对稀土Ce有一个快速细胞表面吸附的过程,都表现出在初期10 h内稀土元素的富集速率明显大于后期阶段,能完成90%以上的富集。3种不同体系中反应初期14天内的吸附速率各有不同,随着反应时间增长,14天后海洋细菌对稀土Ce的富集率都达到98%以上。海洋细菌吸附富集稀土元素的效率主要与细菌密度和稀土元素浓度有关,即主要受金属/生物量比率的影响[33]。另外不同的海洋细菌细胞壁结构不同,对稀土元素的吸附力也有所不同。
2.3 稀土元素Ce富集成矿过程中细菌表面的矿物形态分析
实验中在不同时间间隔取样并收集吸附后的微生物样品,利用SEM和TEM-EDS分析手段测定稀土元素Ce富集成矿过程中Ce形态的变化和所生成的稀土矿物的组成,从而进一步分析讨论海洋细菌对稀土矿化的过程和作用机理。图8显示了菌株CW126-A03富集稀土Ce七天后的SEM图像,反应体系中稀土Ce的初始浓度为1.4 μg/g,细菌干密度为0.26 g/L。SEM图中展示了在细菌表面及周围有大量的沉积颗粒物,颗粒物的大小约几百纳米,有的聚集在一起形成较大的颗粒物,暗示菌株CW126-A03对稀土Ce有富集成矿的作用。菌株CW126-A03和CW126-B11富集稀土Ce 3天后的TEM图像(图9)更清晰地展示了细胞表面富集沉积颗粒的形态,两种海洋细菌表面均聚集了大小不同的微小颗粒物,大小约为50~200 nm,这些颗粒物在细胞表面分布不均匀。有研究报道,不同细菌细胞壁表面总官能团位点密度不同,因而对金属阳离子的吸附和络合能力也不同[30],从而导致不同海洋细菌对稀土元素的吸附富集能力也不同。
图10中显示了菌株CW126-B11富集稀土Ce的TEM-EDS图像,通过EDS进一步解析了细菌表面生成的沉积物颗粒组成,细菌吸附反应3天后在细胞表面形成的颗粒物中含有明显的Ce、P、Si以及其他组成细胞的基本元素成分,并对细胞表面含Ce的矿物颗粒(白色圆圈内)进行了电子衍射光谱的分析,显示矿物颗粒呈现无定形态的非晶相结构。这些数据显示在长时间的吸附过程中海洋细菌表面形成了含稀土元素Ce的磷酸盐或硅酸盐沉淀颗粒,生物吸附导致了稀土元素从反应溶液中的提取并矿化,与前面溶液中Ce浓度变化的数据(图3、7)相吻合。研究结果表明海洋细菌在稀土的矿化过程中起着重要作用,稀土元素先快速吸附在细胞表面,随着吸附时间增长,被吸附的Ce逐渐富集生成含稀土的矿物颗粒(直径50~200 nm)。
研究发现稀土元素可以在细胞表面被矿化形成含稀土Ce的磷酸盐或硅酸盐非晶相结构的矿物颗粒。综合实验结果表明稀土元素Ce首先被吸附在细胞表面形成成核点,随后被吸附的稀土离子与细胞内部释放出来的P等元素反应,在细菌表面形成含有稀土元素Ce的矿物颗粒。说明海洋细菌在稀土的矿化过程中起着重要作用,稀土元素先快速吸附在细胞表面,随着吸附时间增长,逐渐被富集生成含稀土的矿物颗粒(直径50~200 nm),这些矿物颗粒大小可能随富集时间的增长而增大,甚至从细胞表面脱落下来,从而进一步讨论了海洋细菌对稀土元素富集矿化过程和作用机理。
3. 结论
(1)三种不同海洋细菌菌株CW126-A03、菌株CW27-A08、菌株CW126-B11对稀土Ce均有吸附富集作用。海洋细菌吸附富集稀土元素的效率主要与细菌密度和稀土元素浓度有关,即主要受金属元素/生物量比率的影响[33]。另外不同的海洋细菌细胞壁结构不同,对稀土元素的吸附力也有所不同。
(2)利用SEM、TEM-EDS分析测定稀土元素富集成矿过程中稀土元素Ce形态的变化和所生成的稀土矿物的结构,研究发现稀土元素Ce首先被吸附在细胞表面形成成核点,随后被吸附的稀土离子与细胞内部释放出来的P等元素反应,在细胞表面被矿化形成含稀土Ce的磷酸盐或硅酸盐非晶相结构的矿物颗粒。
(3)通过初步开展海洋细菌对稀土元素富集和矿化过程的研究,进一步讨论了海洋微生物成矿的过程和作用机理,期待能为大洋中稀土矿产资源的生物成因过程提供一些理论依据。同时也因实验条件有限,实验室不能完全模拟海底环境,模拟实验中还存在一些不足之处,期待本研究能为后面的研究提供一些借鉴。
-
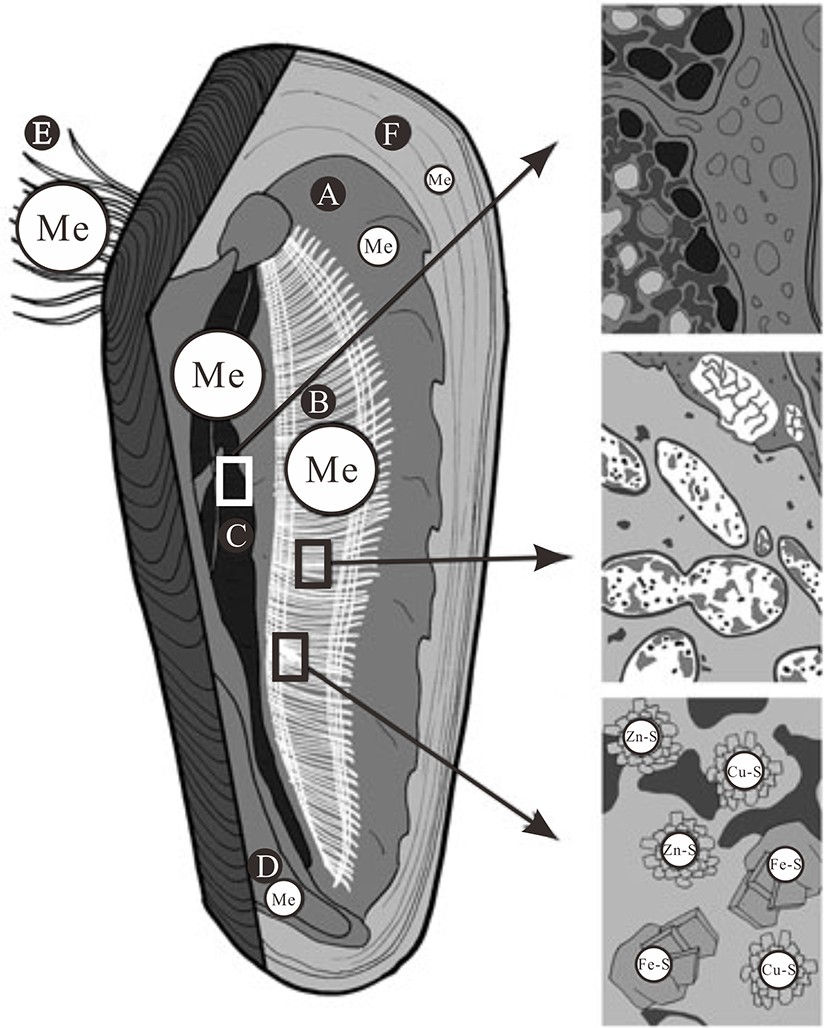
图 2 热液贻贝元素富集概念图
A.外套膜,B.腮(主要包括共生菌和金属矿物),C.消化腺(主要为金属颗粒),D.足,E.足丝组织,F.壳[45] 。
Figure 2. Sketch of hydrothermal mussel tissues metal accumulation
A.mantle, B.gills(symbiotic bacteria and metal-bearing mineral particles in the gills), C.digestive gland(metal-rich granules in the digestive gland), D.foot, E.byssus thread, F.shell[45].
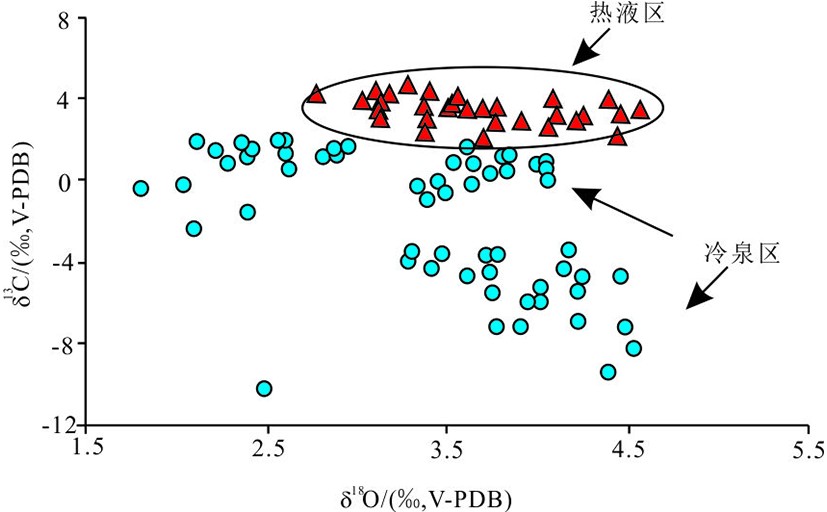
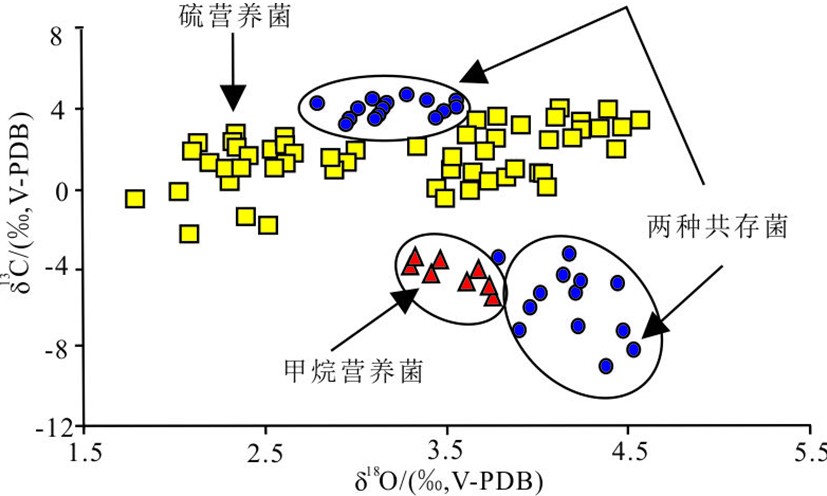
图 5 不同共生菌的生物壳体碳氧同位素分布图[68]
红色三角为共生甲烷营养菌生物壳体,黄色方形为共生硫营养菌贻生物壳体,蓝色圆圈为两类菌都存在的生物壳体[68]。
Figure 5. Distribution of oxygen and carbon isotope compositions according to the type of symbiotic bacteria present in bivalve gills[68]
Red triangle: bivalves harboring only methanotrophic bacteria, yellow rectangle bivalves harboring only sulfide-oxidizing bacteria, bule circle: bivalves harboring sulfide-oxidizing and methanotrophic bacteria[68].
表 1 海底冷泉和热液系统宏体生物的地球化学记录特征对比
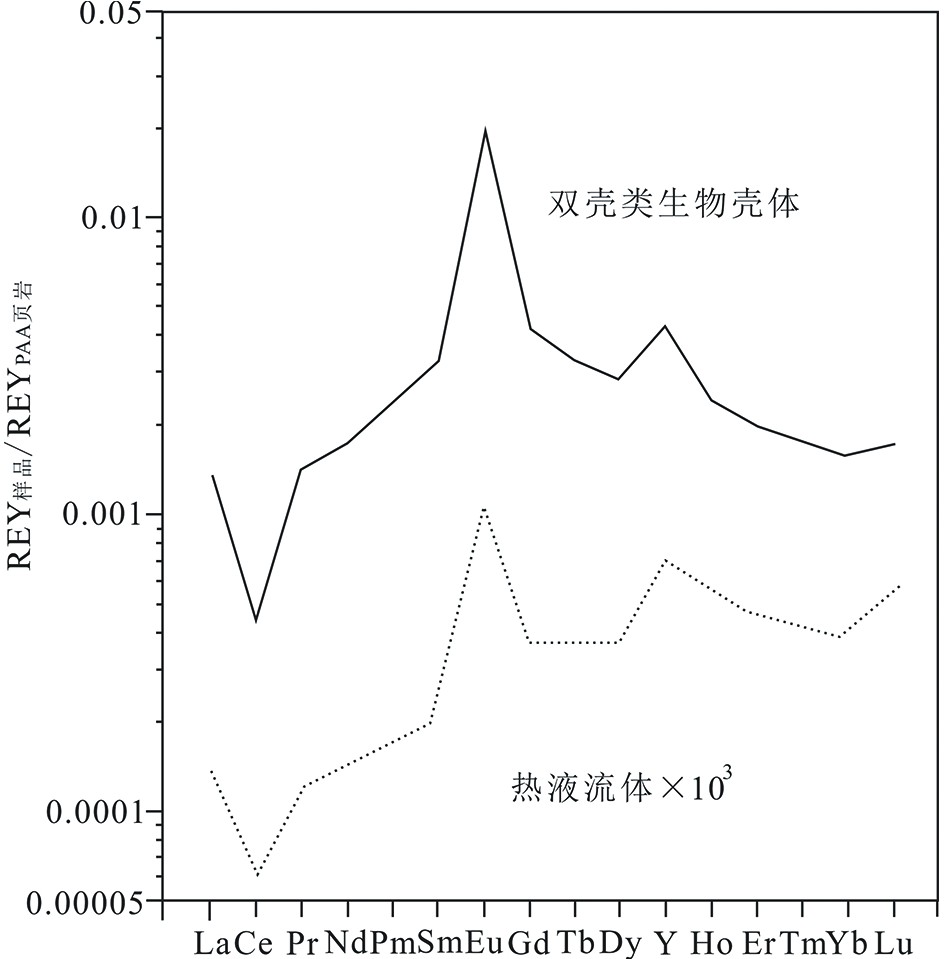
Table 1 Comparison of geochemical record characteristics of macrobiota of seafloor cold seeps and hydrothermal systems
相似点流体浓度决定生物种类和数量 记录栖息地地球化学特征 生物体不同组织的元素种类和含量不同 微生物过程和周围环境影响生物同位素信息
不同点热液区生物种类和数量受温度影响较大 热液区生物的金属元素含量更高 稀土元素的富集模式不同 生物标志物种类不同 -
[1] 魏合龙, 孙治雷, 王利波, 等. 天然气水合物系统的环境效应[J]. 海洋地质与第四纪地质, 2016, 36(1):1-13 WEI Helong, SUN Zhilei, WANG Libo, et al. Perspective of the environmental effect of natural gas hydrate system [J]. Marine Geology & Quaternary Geology, 2016, 36(1): 1-13.
[2] 席世川, 张鑫, 王冰, 等. 海底冷泉标志与主要冷泉区的分布和比较[J]. 海洋地质前沿, 2017, 33(2):7-18 XI Shichuan, ZHANG Xin, WANG Bing, et al. The indicators of seabed cold seep and comparison among main distribution areas [J]. Marine Geology Frontiers, 2017, 33(2): 7-18.
[3] Sun Z L, Wu N Y, Cao H, et al. Hydrothermal metal supplies enhance the benthic methane filter in oceans: an example from the Okinawa Trough [J]. Chemical Geology, 2019, 525: 190-209. doi: 10.1016/j.chemgeo.2019.07.025
[4] Nakajima Y, Shinzato C, Khalturina M, et al. Isolation and characterization of novel polymorphic microsatellite loci for the deep-sea hydrothermal vent limpet, Lepetodrilus nux, and the vent-associated squat lobster, Shinkaia crosnieri [J]. Marine Biodiversity, 2018, 48(1): 677-684. doi: 10.1007/s12526-017-0704-5
[5] Parson L M, Walker C L, Dixon D R. Hydrothermal vents and processes [J]. Geological Society, London, Special Publications, 1995, 87: 1-2. doi: 10.1144/GSL.SP.1995.087.01.01
[6] German C R, Seyfried W E Jr. Hydrothermal processes [J]. Treatise on Geochemistry, 2014, 6: 191-233.
[7] Cardigos F, Colaço A, Dando P R, et al. Shallow water hydrothermal vent field fluids and communities of the D. João de Castro Seamount (Azores) [J]. Chemical Geology, 2005, 224(1-3): 153-168. doi: 10.1016/j.chemgeo.2005.07.019
[8] Melwani A R, Kim S L. Benthic infaunal distributions in shallow hydrothermal vent sediments [J]. Acta Oecologica, 2008, 33(2): 162-175. doi: 10.1016/j.actao.2007.10.008
[9] Dando P R. Biological communities at marine shallow-water vent and seep sites[M]//Kiel S. The Vent and Seep Biota. Dordrecht: Springer, 2010: 333-378.
[10] Markulin K, Peharda M, Mertz-Kraus R, et al. Trace and minor element records in aragonitic bivalve shells as environmental proxies [J]. Chemical Geology, 2019, 507: 120-133. doi: 10.1016/j.chemgeo.2019.01.008
[11] Galkin S V. Structure of hydrothermal vent communities[M]//Demina L L, Galkin S V. Trace Metal Biogeochemistry and Ecology of Deep-Sea Hydrothermal Vent Systems. Cham: Springer, 2016: 77-95.
[12] Schreier J E, Lutz R A. Hydrothermal vent biota[M]//Steele J H. Encyclopedia of Ocean Sciences. Elsevier: Academic Press, 2019: 308-319.
[13] Dattagupta S, Arthur M A, Fisher C R. Modification of sediment geochemistry by the hydrocarbon seep tubeworm Lamellibrachia luymesi: a combined empirical and modeling approach [J]. Geochimica et Cosmochimica Acta, 2008, 72(9): 2298-2315. doi: 10.1016/j.gca.2008.02.016
[14] Taviani M, Angeletti L, Ceregato A, et al. The Gela Basin pockmark field in the strait of Sicily (Mediterranean Sea): chemosymbiotic faunal and carbonate signatures of postglacial to modern cold seepage [J]. Biogeosciences, 2013, 10(7): 4653-4671. doi: 10.5194/bg-10-4653-2013
[15] Lenihan H S, Mills S W, Mullineaux L S, et al. Biotic interactions at hydrothermal vents: recruitment inhibition by the mussel Bathymodiolus thermophilus [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2008, 55(12): 1707-1717. doi: 10.1016/j.dsr.2008.07.007
[16] Karpen V, Thomsen L, Suess E. Groundwater discharges in the Baltic Sea: survey and quantification using a schlieren technique application [J]. Geofluids, 2010, 6(3): 241-250.
[17] Jensen P, Aagaard I, Burke R A Jr, et al. ‘Bubbling reefs’ in the Kattegat: submarine landscapes of carbonate-cemented rocks support a diverse ecosystem at methane seeps [J]. Marine Ecology Progress Series, 1992, 83: 103-112. doi: 10.3354/meps083103
[18] Snelgrove P V R. Hydrodynamic enhancement of invertebrate larval settlement in microdepositional environments: colonization tray experiments in a muddy habitat [J]. Journal of Experimental Marine Biology and Ecology, 1994, 176(2): 149-166. doi: 10.1016/0022-0981(94)90182-1
[19] Tarasov V G, Gebruk A V, Mironov A N, et al. Deep-sea and shallow-water hydrothermal vent communities: two different phenomena? [J]. Chemical Geology, 2005, 224(1-3): 5-39. doi: 10.1016/j.chemgeo.2005.07.021
[20] Mae A, Yamanaka T, Shimoyama S. Stable isotope evidence for identification of chemosynthesis-based fossil bivalves associated with cold-seepages [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 245(3-4): 411-420. doi: 10.1016/j.palaeo.2006.09.003
[21] Dando P R, Aliani S, Arab H, et al. Hydrothermal studies in the Aegean Sea [J]. Physics and Chemistry of the Earth, Part B:Hydrology, Oceans and Atmosphere, 2000, 25(1): 1-8. doi: 10.1016/S1464-1909(99)00112-4
[22] Beccari V, Basso D, Spezzaferri S, et al. Preliminary video-spatial analysis of cold seep bivalve beds at the base of the continental slope of Israel (Palmahim Disturbance) [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2020, 171: 104664. doi: 10.1016/j.dsr2.2019.104664
[23] Guillon E, Menot L, Decker C, et al. The vesicomyid bivalve habitat at cold seeps supports heterogeneous and dynamic macrofaunal assemblages [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2017, 120: 1-13. doi: 10.1016/j.dsr.2016.12.008
[24] Campbell K A, Bottjer D J. Brachiopods and chemosymbiotic bivalves in Phanerozoic hydrothermal vent and cold seep environments [J]. Geology, 1995, 23(4): 321-324. doi: 10.1130/0091-7613(1995)023<0321:BACBIP>2.3.CO;2
[25] Feng D, Roberts H H. Initial results of comparing cold-seep carbonates from mussel- and tubeworm-associated environments at Atwater Valley lease block 340, northern Gulf of Mexico [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2010, 57(21-23): 2030-2039. doi: 10.1016/j.dsr2.2010.05.004
[26] Pellerin A, Antler G, Røy H, et al. The sulfur cycle below the sulfate-methane transition of marine sediments [J]. Geochimica et Cosmochimica Acta, 2018, 239: 74-89. doi: 10.1016/j.gca.2018.07.027
[27] Duros P, Silva Jacinto R, Dennielou B, et al. Benthic foraminiferal response to sedimentary disturbance in the Capbreton canyon (Bay of Biscay, NE Atlantic) [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2017, 120: 61-75. doi: 10.1016/j.dsr.2016.11.012
[28] Khripounoff A, Caprais J C, Decker C, et al. Variability in gas and solute fluxes through deep-sea chemosynthetic ecosystems inhabited by vesicomyid bivalves in the Gulf of Guinea [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2015, 95: 122-130. doi: 10.1016/j.dsr.2014.10.013
[29] Marlow J J, Steele J A, Ziebis W, et al. Carbonate-hosted methanotrophy represents an unrecognized methane sink in the deep sea [J]. Nature Communications, 2014, 5(1): 5094. doi: 10.1038/ncomms6094
[30] Toyama K, Paytan A, Sawada K, et al. Sulfur isotope ratios in co-occurring barite and carbonate from Eocene sediments: a comparison study [J]. Chemical Geology, 2020, 535: 119454. doi: 10.1016/j.chemgeo.2019.119454
[31] Roberts H H, Feng D. Carbonate precipitation at gulf of mexico hydrocarbon seeps: an overview[M]//Aminzadeh F, Berge T B, Connolly D L. Hydrocarbon Seepage. American: Society of Exploration Geophysicists, 2013: 43-61.
[32] Scheller S, Yu H, Chadwick G L, et al. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction [J]. Science, 2016, 351(6274): 703-707. doi: 10.1126/science.aad7154
[33] Tong H P, Feng D, Cheng H, et al. Authigenic carbonates from seeps on the northern continental slope of the South China Sea: New insights into fluid sources and geochronology [J]. Marine and Petroleum Geology, 2013, 43: 260-271. doi: 10.1016/j.marpetgeo.2013.01.011
[34] Dattagupta S, Miles L L, Barnabei M S, et al. The hydrocarbon seep tubeworm Lamellibrachia luymesi primarily eliminates sulfate and hydrogen ions across its roots to conserve energy and ensure sulfide supply [J]. Journal of Experimental Biology, 2006, 209(19): 3795-3805. doi: 10.1242/jeb.02413
[35] Cordes E E, Becker E L, Hourdez S, et al. Influence of foundation species, depth, and location on diversity and community composition at Gulf of Mexico lower-slope cold seeps [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2010, 57(21-23): 1870-1881. doi: 10.1016/j.dsr2.2010.05.010
[36] Kádár E, Costa V. First report on the micro-essential metal concentrations in bivalve shells from deep-sea hydrothermal vents [J]. Journal of Sea Research, 2006, 56(1): 37-44. doi: 10.1016/j.seares.2006.01.001
[37] 冯东, 宫尚桂. 海底冷泉系统硫的生物地球化学过程及其沉积记录研究进展[J]. 矿物岩石地球化学通报, 2019, 38(6):1047-1056 FENG Dong, GONG Shanggui. Progress on the biogeochemical process of sulfur and its geological record at submarine cold seeps [J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2019, 38(6): 1047-1056.
[38] Basso D, Beccari V, Almogi-Labin A, et al. Macro- and micro-fauna from cold seeps in the Palmahim Disturbance (Israeli off-shore), with description of Waisiuconcha corsellii n. sp. (Bivalvia, Vesicomyidae) [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2020, 171: 104723. doi: 10.1016/j.dsr2.2019.104723
[39] Zeng Z G, Chen S, Ma Y, et al. Chemical compositions of mussels and clams from the Tangyin and Yonaguni Knoll IV hydrothermal fields in the southwestern Okinawa Trough [J]. Ore Geology Reviews, 2017, 87: 172-191. doi: 10.1016/j.oregeorev.2016.09.015
[40] Amano K, Jenkins R G, Sako Y, et al. A Paleogene deep-sea methane-seep community from Honshu, Japan [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 387: 126-133. doi: 10.1016/j.palaeo.2013.07.015
[41] Pavlidou A, Velaoras D, Karageorgis A P, et al. Seasonal variations of biochemical and optical properties, physical dynamics and N stable isotopic composition in three northeastern Mediterranean basins (Aegean, Cretan and Ionian Seas) [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2020, 171: 104704. doi: 10.1016/j.dsr2.2019.104704
[42] Almeida M J, Machado J, Moura G, et al. Temporal and local variations in biochemical composition of Crassostrea gigas shells [J]. Journal of Sea Research, 1998, 40(3-4): 233-249. doi: 10.1016/S1385-1101(98)00033-1
[43] Wang X C, Li C L, Zhou L. Metal concentrations in the mussel Bathymodiolus platifrons from a cold seep in the South China Sea [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2017, 129: 80-88. doi: 10.1016/j.dsr.2017.10.004
[44] Ruelas-Inzunza J, Soto L A, Páez-Osuna F. Heavy-metal accumulation in the hydrothermal vent clam Vesicomya gigas from Guaymas basin, Gulf of California [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2003, 50(6): 757-761. doi: 10.1016/S0967-0637(03)00054-2
[45] Koschinsky A. Sources and forms of trace metals taken up by hydrothermal vent mussels, and possible adaption and mitigation strategies[M]//Demina L L, Galkin S V. Trace Metal Biogeochemistry and Ecology of Deep-Sea Hydrothermal Vent Systems. Cham: Springer, 2016: 97-122.
[46] Bau M. Rare-earth element mobility during hydrothermal and metamorphic fluid-rock interaction and the significance of the oxidation state of europium [J]. Chemical Geology, 1991, 93(3-4): 219-230. doi: 10.1016/0009-2541(91)90115-8
[47] Bau M, Balan S, Schmidt K, et al. Rare earth elements in mussel shells of the Mytilidae family as tracers for hidden and fossil high-temperature hydrothermal systems [J]. Earth and Planetary Science Letters, 2010, 299(3-4): 310-316. doi: 10.1016/j.jpgl.2010.09.011
[48] 李景喜, 孙承君, 蒋凤华, 等. 印度洋热液区贻贝及栖息沉积物中金属元素的特征分析[J]. 分析化学, 2017, 45(9):1316-1322 doi: 10.11895/j.issn.0253-3820.170348 LI Jingxi, SUN Chengjun, JIANG Fenghua, et al. Characteristics analysis of metal elements in sediments and habitat mussels from india ocean hydrothermal area [J]. Chinese Journal of Analytical Chemistry, 2017, 45(9): 1316-1322. doi: 10.11895/j.issn.0253-3820.170348
[49] Vanreusel A, De Groote A, Gollner S, et al. Ecology and biogeography of free-living nematodes associated with chemosynthetic environments in the deep sea: a review [J]. PLoS One, 2010, 5(8): e12449. doi: 10.1371/journal.pone.0012449
[50] Shiller A M, Chan E W, Joung D J, et al. Light rare earth element depletion during Deepwater Horizon blowout methanotrophy [J]. Scientific Reports, 2017, 7(1): 10389. doi: 10.1038/s41598-017-11060-z
[51] Wang X, Barrat J A, Bayon G, et al. Lanthanum anomalies as fingerprints of methanotrophy [J]. Geochemical Perspectives Letters, 2020, 14: 26-30. doi: 10.7185/geochemlet.2019
[52] Akagi T, Edanami K. Sources of rare earth elements in shells and soft-tissues of bivalves from Tokyo Bay [J]. Marine Chemistry, 2017, 194: 55-62. doi: 10.1016/j.marchem.2017.02.009
[53] Yamanaka T, Mizota C, Fujiwara Y, et al. Sulphur-isotopic composition of the deep-sea mussel Bathymodiolus marisindicus from currently active hydrothermal vents in the Indian Ocean [J]. Journal of the Marine Biological Association of the United Kingdom, 2003, 83(4): 841-848. doi: 10.1017/S0025315403007872h
[54] Paull C K, Jull A J T, Toolin L J, et al. Stable isotope evidence for chemosynthesis in an abyssal seep community [J]. Nature, 1985, 317(6039): 709-711. doi: 10.1038/317709a0
[55] Suzuki Y, Sasaki T, Suzuki M, et al. Novel chemoautotrophic endosymbiosis between a member of the Epsilonproteobacteria and the hydrothermal-vent gastropod Alviniconcha aff. hessleri (Gastropoda: Provannidae) from the Indian Ocean [J]. Applied and Environmental Microbiology, 2005, 71(9): 5440-5450. doi: 10.1128/AEM.71.9.5440-5450.2005
[56] Yamanaka T, Shimamura S, Nagashio H, et al. A compilation of the stable isotopic compositions of carbon, nitrogen, and sulfur in soft body parts of animals collected from deep-sea hydrothermal vent and methane seep fields: variations in energy source and importance of subsurface microbial processes in the sediment-hosted systems[M]//Ishibashi J I, Okino K, Sunamura M. Subseafloor Biosphere Linked to Hydrothermal Systems. Tokyo: Springer, 2015: 105-129.
[57] De Ronde C E J, Massoth G J, Butterfield D A, et al. Submarine hydrothermal activity and gold-rich mineralization at Brothers Volcano, Kermadec Arc, New Zealand [J]. Mineralium Deposita, 2011, 46(5-6): 541-584. doi: 10.1007/s00126-011-0345-8
[58] Markert S, Arndt C, Felbeck H, et al. Physiological proteomics of the uncultured endosymbiont of Riftia pachyptila [J]. Science, 2007, 315(5809): 247-250. doi: 10.1126/science.1132913
[59] Bell J B, Reid W D K, Pearce D A, et al. Hydrothermal activity lowers trophic diversity in Antarctic sedimented hydrothermal vents[J]. Biogeosciences, 2016,doi: 10.5194/bg-2016-318.
[60] Portail M, Olu K, Dubois S F, et al. Food-web complexity in guaymas basin hydrothermal vents and cold seeps [J]. PLoS One, 2016, 11(9): e0162263. doi: 10.1371/journal.pone.0162263
[61] Vetter R D, Fry B. Sulfur contents and sulfur-isotope compositions of thiotrophic symbioses in bivalve molluscs and vestimentiferan worms [J]. Marine Biology, 1998, 132(3): 453-460. doi: 10.1007/s002270050411
[62] Rodrigues C F, Hilário A, Cunha M R. Chemosymbiotic species from the Gulf of Cadiz (NE Atlantic): distribution, life styles and nutritional patterns [J]. Biogeosciences, 2013, 10(4): 2569-2581. doi: 10.5194/bg-10-2569-2013
[63] Feng D, Cheng M, Kiel S, et al. Using Bathymodiolus tissue stable carbon, nitrogen and sulfur isotopes to infer biogeochemical process at a cold seep in the South China Sea [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2015, 104: 52-59. doi: 10.1016/j.dsr.2015.06.011
[64] Ye F C, Crippa G, Angiolini L, et al. Mapping of recent brachiopod microstructure: a tool for environmental studies [J]. Journal of Structural Biology, 2018, 201(3): 221-236. doi: 10.1016/j.jsb.2017.11.011
[65] Kardon G. Evidence from the fossil record of an antipredatory exaptation: conchiolin layers in corbulid bivalves [J]. Evolution, 1998, 52(1): 68-79. doi: 10.1111/j.1558-5646.1998.tb05139.x
[66] Hein J R, Normark W R, Mcintyre B R, et al. Methanogenic calcite, 13C-depleted bivalve shells, and gas hydrate from a mud volcano offshore southern California [J]. Geology, 2006, 34(2): 109-112. doi: 10.1130/G22098.1
[67] Ambrose W G Jr, Panieri G, Schneider A, et al. Bivalve shell horizons in seafloor pockmarks of the last glacial‐interglacial transition: a thousand years of methane emissions in the Arctic Ocean [J]. Geochemistry, Geophysics, Geosystems, 2015, 16(12): 4108-4129. doi: 10.1002/2015GC005980
[68] Lietard C, Pierre C. Isotopic signatures (δ18O and δ13C) of bivalve shells from cold seeps and hydrothermal vents [J]. Geobios, 2009, 42(2): 209-219. doi: 10.1016/j.geobios.2008.12.001
[69] Dreier A, Loh W, Blumenberg M, et al. The isotopic biosignatures of photo- vs. thiotrophic bivalves: are they preserved in fossil shells? [J]. Geobiology, 2014, 12(5): 406-423. doi: 10.1111/gbi.12093
[70] Kiel S, Taviani M. Chemosymbiotic bivalves from Miocene methane-seep carbonates in Italy [J]. Journal of Paleontology, 2017, 91(3): 444-466. doi: 10.1017/jpa.2016.154
[71] Michener R H, Lajtha K. Stable Isotopes in Ecology and Environmental Science[M]. 2nd ed. Oxford: Blackwell Publishing Ltd, 2007.
[72] O’Donnell T H, Macko S A, Chou J, et al. Analysis of δ13C, δ15N, andδ34S in organic matter from the biominerals of modern and fossil Mercenaria spp. [J]. Organic Geochemistry, 2003, 34(2): 165-183. doi: 10.1016/S0146-6380(02)00160-2
[73] Feng D, Peckmann J, Li N, et al. The stable isotope fingerprint of chemosymbiosis in the shell organic matrix of seep-dwelling bivalves [J]. Chemical Geology, 2018, 479: 241-250. doi: 10.1016/j.chemgeo.2018.01.015
[74] Yan Y X, Sun C J, Huang Y H, et al. Distribution characteristics of lipids in hadal sediment in the Yap Trench [J]. Journal of Oceanology and Limnology, 2020, 38(3): 634-649. doi: 10.1007/s00343-019-8120-2
[75] Ding L, Zhao M X, Yu M, et al. Biomarker assessments of sources and environmental implications of organic matter in sediments from potential cold seep areas of the northeastern South China Sea [J]. Acta Oceanologica Sinica, 2017, 36(10): 8-19. doi: 10.1007/s13131-017-1068-1
[76] Guan H X, Sun Z L, Mao S Y, et al. Authigenic carbonate formation revealed by lipid biomarker inventory at hydrocarbon seeps: a case study from the Okinawa Trough [J]. Marine and Petroleum Geology, 2019, 101: 502-511. doi: 10.1016/j.marpetgeo.2018.12.028
[77] Guerreiro V, Narciso L, Almeida A J, et al. Fatty acid profiles of deep-sea fishes from the Lucky Strike and Menez Gwen hydrothermal vent fields (Mid-Atlantic ridge) [J]. Cybium, 2004, 28(1): 33-44.
[78] Pond D W, Gebruk A, Southward E C, et al. Unusual fatty acid composition of storage lipids in the bresilioid shrimp Rimicaris exoculata couples the photic zone with MAR hydrothermal vent sites [J]. Marine Ecology Progress Series, 2000, 198: 171-179. doi: 10.3354/meps198171
[79] Yamanaka T, Sakata S. Abundance and distribution of fatty acids in hydrothermal vent sediments of the western Pacific Ocean [J]. Organic Geochemistry, 2004, 35(5): 573-582. doi: 10.1016/j.orggeochem.2004.01.002
[80] Li J W, Zhou H Y, Peng X T, et al. Abundance and distribution of fatty acids within the walls of an active deep-sea sulfide chimney [J]. Journal of Sea Research, 2011, 65(3): 333-339. doi: 10.1016/j.seares.2011.01.005
[81] 万志峰, 张伟, 陈崇敏, 等. 琼东南盆地冷泉差异发育特征及其深部控制机理[J]. 海洋地质前沿, 2021, 37(7):1-10 WAN Zhifeng, ZHANG Wei, CHEN Chongmin, et al. Hydrodynamic characteristics of cold seep differential development in the Qiongdongnan Basin and their deep controlling mechanisms [J]. Marine Geology Frontiers, 2021, 37(7): 1-10.
[82] Li J T, Mara P, Schubotz F, et al. Recycling and metabolic flexibility dictate life in the lower oceanic crust [J]. Nature, 2020, 579(7798): 250-255. doi: 10.1038/s41586-020-2075-5
[83] Watkins J M, Hunt J D. A process-based model for non-equilibrium clumped isotope effects in carbonates [J]. Earth and Planetary Science Letters, 2015, 432: 152-165. doi: 10.1016/j.jpgl.2015.09.042
[84] McConnaughey T. 13C and 18O isotopic disequilibrium in biological carbonates: II. In vitro simulation of kinetic isotope effects [J]. Geochimica et Cosmochimica Acta, 1989, 53(1): 163-171. doi: 10.1016/0016-7037(89)90283-4
-
期刊类型引用(1)
1. 姜雪. 源汇系统约束下的浅水三角洲沉积特征及控砂因素——以西湖凹陷A构造花港组为例. 上海国土资源. 2025(01): 167-173 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: