Progress in in-situ observation of methane flux at sediment-water interface in cold seep
-
摘要: 海底沉积物-水界面作为冷泉跨圈层活动最关键的界面,近年来已成为冷泉区碳循环研究调查的重点目标。为准确获取海洋沉积物-水界面的流体通量,客观重建界面环境过程,评估环境效应,必须发展一整套精确、高效、科学的水下原位甲烷通量测量技术。综述了当前海洋冷泉区沉积物-水界面甲烷通量研究的意义与价值,详细介绍了多种较为成熟的海洋沉积物-水界面甲烷原位通量测试技术工作原理、使用方法和优缺点等,如测试游离气泡态甲烷通量的渗漏帐篷、声学反射、时序影像等技术方法,原位溶解态甲烷膜脱气技术的甲烷传感器、激光拉曼光谱测量方法等,同时对全球该领域已经调查的地区、研究现状和进展进行了详细的介绍。最后从技术层面对这一研究领域未来的发展方向和趋势进行展望,以期为未来国内海洋冷泉区沉积物-水界面甲烷通量原位观测研究提供思路与方向借鉴。Abstract: As the most critical interface, the seabed sediment-water interface has become the key target of carbon cycle research in cold seep in recent years. To obtain accurately the fluid flux at marine sediment-water interface, reconstruct objectively the interface environmental processes, and evaluate the environmental effects, a complete set of accurate, efficient, and scientific underwater in-situ measurement techniques of methane flux shall be developed. The significance and value of methane flux at sediment-water interface in cold seep are reviewed in the topics including working principle, methods, advantages and disadvantages of free bubble methane flux seep tent, acoustic reflection, timing imaging, in situ dissolved methane membrane methane sensor, and laser Raman spectral measurement methods. The investigated regions, research status, and progress in the field are presented. Finally, the future direction and trend of development in this field are expected in technical aspect, to provide a reference for the in situ observation of methane flux in marine cold seep.
-
Keywords:
- cold seep /
- sediment-water interface /
- methane flux /
- in-situ measurement /
- trend of development
-
-
图 6 半自动气泡计数法处理流程示意图[57]
a: 从原始图像中选定气泡计数区域并转换灰度;b-c: 消除气泡计数区域的背景图像并将气泡转化为(d)中的亮斑;e: 对每一帧图像的每根像素线上的气泡数进行计数求和、取平均值。
Figure 6. Schematic diagram depicting the image‐processing method using semi-automatic bubble counting
a: Bubbles shown in the original image are cropped and counted and the image is converted to grayscale; b-c: the background image of bubble counting area is removed, and bubbles are converted into bright spots as shown in (d); e: the number of bubbles on each pixel line of each frame of image are counted, summed, and averaged.
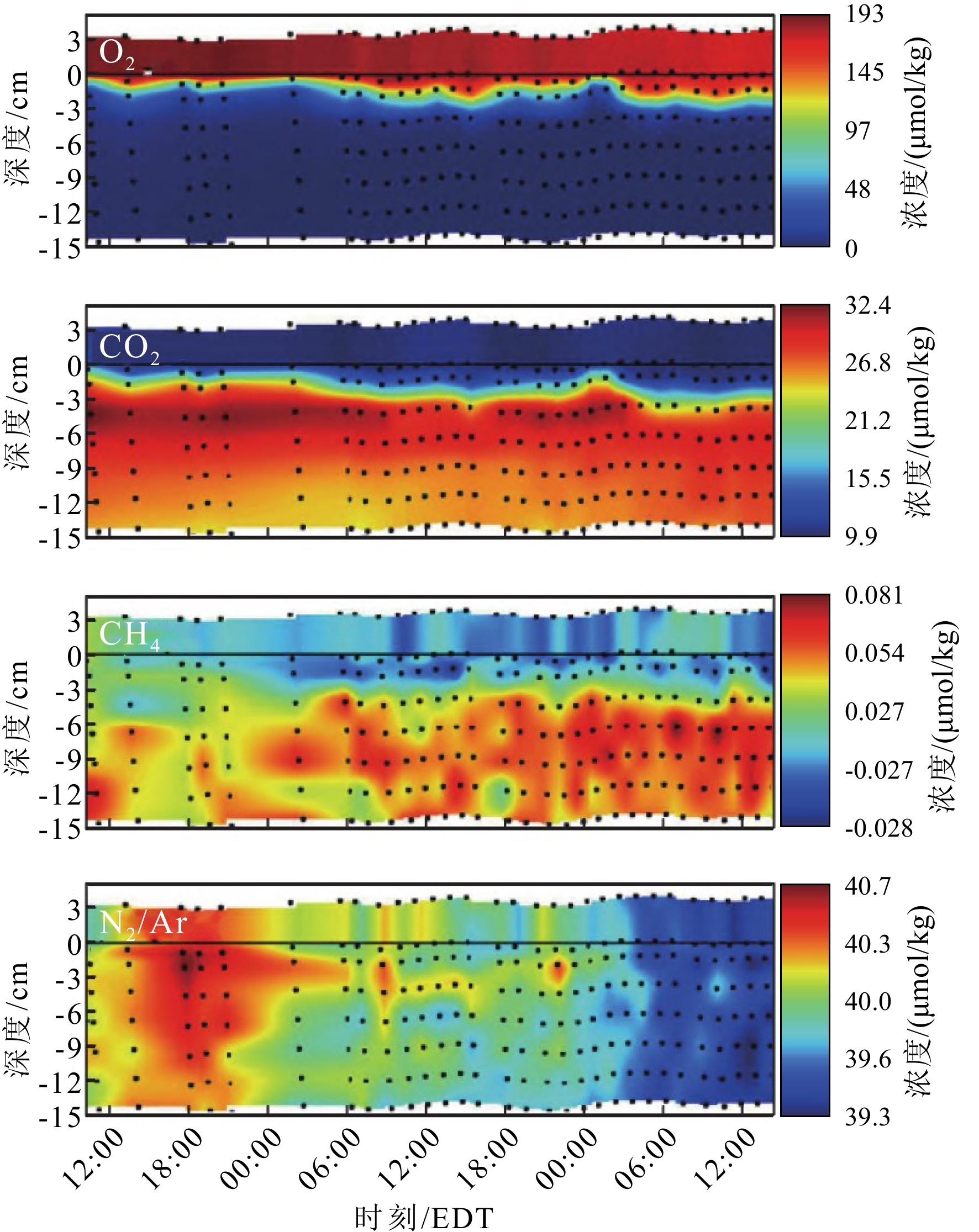
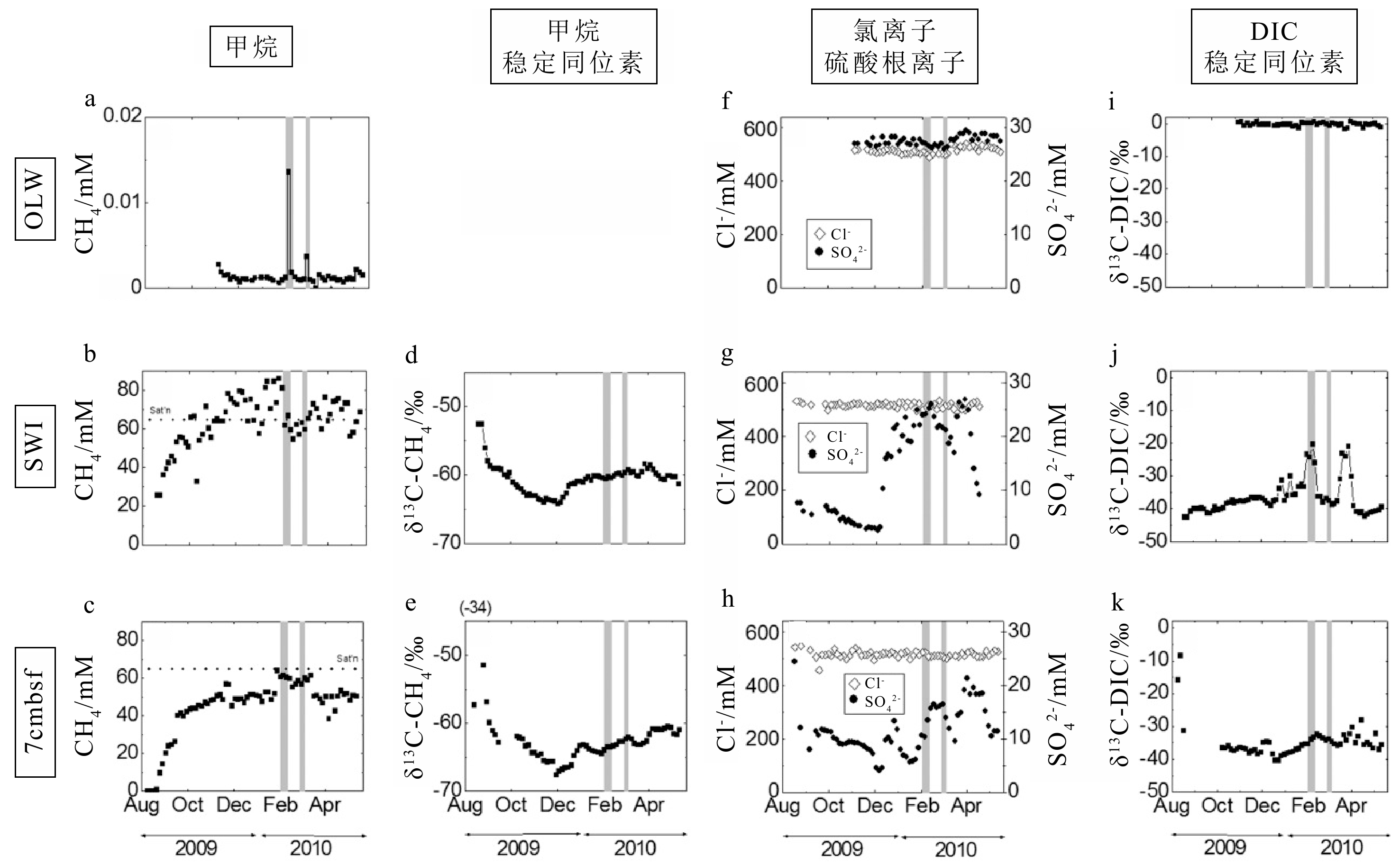
图 8 甲烷及其他化学参数随时间变化特征[64]
a-c: 甲烷浓度, d-e: 甲烷中稳定碳同位素,f-h: 氯离子浓度及硫酸根浓度,i-k: 溶解无机碳同位素;OLW为海底以上25 cm处,SWI为沉积物水界面处,7 cmbsf为海底以下7 cm处。
Figure 8. Characteristics of methane and other chemical parameters over time[64]
a-c: Methane concentrations; d-e; stable carbon isotopes of methane; f-h: chloride and sulfate concentrations; i-k: stable carbon isotopes of DIC (dissolved inorganic carbon). OLW: overlying water from 25 cm above seafloor. SWI: sediment-water interface. cmbsf: centimeter below seafloor
表 1 溶解态甲烷检测仪器比较
Table 1 Comparison of instruments for soluble methane detection
表 2 圣塔芭芭拉海峡COP重要渗漏点沉积物-水界面气体通量[53]
Table 2 Gas fluxes at water-sediment interface from SantaBarbara marine seeps[53]
渗漏点 调查区域
面积/km2渗漏活跃区
面积/km2Qmax
/(m−3·m−2·d−1)Qtotal
/(m−3·d−1)Platform Holly 0.367 0.034 0.75 1 490 Seep Tent 0.338 0.051 0.19 990 La Goleta 0.375 0.215 0.57 5 350 Patch 0.366 0.203 0.13 4 220 Trilogy 0.747 0.187 2.6 8 980 -
[1] 王亚, 周卫健, 程鹏. 碳同位素方法在水体溶解有机碳来源解析中的应用[J]. 地球环境学报, 2020, 11(4):435-446 doi: 10.7515/JEE192050 WANG Ya, ZHOU Weijian, CHENG Peng. Sources analysis of dissolved organic carbon in water using carbon isotope method [J]. Journal of Earth Environment, 2020, 11(4): 435-446. doi: 10.7515/JEE192050
[2] Levin L A. Ecology of cold seep sediments: interactions of fauna with flow, chemistry and microbes[M]//Gibson R N, Atkinson R J A, Gordon J D M. Oceanography and Marine Biology: An Annual Review. Boca Raton: CRC Press, 2005, 43: 1-46.
[3] Levin L A, Baco A R, Bowden D A, et al. Hydrothermal vents and methane seeps: rethinking the sphere of influence [J]. Frontiers in Marine Science, 2016, 3: 72.
[4] 陈多福, 陈先沛, 陈光谦. 冷泉流体沉积碳酸盐岩的地质地球化学特征[J]. 沉积学报, 2002, 20(1):34-40 doi: 10.3969/j.issn.1000-0550.2002.01.007 CHEN Duofu, CHEN Xianpei, CHEN Guangqian. Geology and geochemistry of cold seepage and venting-related carbonates [J]. Acta Sedimentologica Sinica, 2002, 20(1): 34-40. doi: 10.3969/j.issn.1000-0550.2002.01.007
[5] 张艳平. 南海几个典型冷泉区浅层沉积物中有机质、甲烷和溶解无机碳循环估算及甲烷渗漏模式[D]. 中国科学院大学(中国科学院广州地球化学研究所)博士学位论文, 2020 ZHANG Yanping. An assessment of subseafloor organic matter, methane, and dissolved inorganic carbon cycling in several typical cold seeps, South China Sea and methane seepage pattern[D]. Doctor Dissertation of Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, 2020.
[6] 孙治雷, 魏合龙, 王利波, 等. 海底冷泉系统的碳循环问题及探测[J]. 应用海洋学学报, 2016, 35(3):442-450 SUN Zhilei, WEI Helong, WANG Libo, et al. Focus issues of carbon cycle and detecting technologies in seafloor cold seepages [J]. Journal of Applied Oceanography, 2016, 35(3): 442-450.
[7] 李学刚, 宋金明. 海洋沉积物中碳的来源、迁移和转化[J]. 海洋科学集刊, 2004(46): 106-117 LI Xuegang, SONG Jinming. Sources, removal and transformation of carbon in marine sediments[J]. Studia Marina Sinica, 2004(46): 106-117. ]
[8] Paull C K, Ussler Iii W. History and Significance of Gas Sampling During DSDP and ODP Drilling Associated with Gas Hydrates[M]. 2001, 53-65.
[9] Xu S N, Sun Z L, Geng W, et al. Advance in numerical simulation research of marine methane processes [J]. Frontiers in Earth Science, 2022, 10: 891393. doi: 10.3389/feart.2022.891393
[10] Reeburgh W S. Oceanic methane biogeochemistry [J]. Chemical Reviews, 2007, 107(2): 486-513. doi: 10.1021/cr050362v
[11] Tryon M, Brown K, Dorman L, et al. A new benthic aqueous flux meter for very low to moderate discharge rates [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2001, 48(9): 2121-2146. doi: 10.1016/S0967-0637(01)00002-4
[12] Sommer S, Türk M, Kriwanek S, et al. Gas exchange system for extended in situ benthic chamber flux measurements under controlled oxygen conditions: first application - Sea bed methane emission measurements at Captain Arutyunov mud volcano [J]. Limnology and Oceanography:Methods, 2008, 6(1): 23-33. doi: 10.4319/lom.2008.6.23
[13] Linke P, Sommer S, Rovelli L, et al. Physical limitations of dissolved methane fluxes: the role of bottom-boundary layer processes [J]. Marine Geology, 2010, 272(1-4): 209-222. doi: 10.1016/j.margeo.2009.03.020
[14] Boetius A, Wenzhöfer F. Seafloor oxygen consumption fuelled by methane from cold seeps [J]. Nature Geoscience, 2013, 6(9): 725-734. doi: 10.1038/ngeo1926
[15] Alperin M, Hoehler T. The ongoing mystery of sea-floor methane [J]. Science, 2010, 329(5989): 288-289. doi: 10.1126/science.1189966
[16] 赵广涛, 徐翠玲, 张晓东, 等. 海底沉积物-水界面溶解甲烷渗漏通量原位观测研究进展[J]. 中国海洋大学学报, 2014, 44(12):73-81 ZHAO Guangtao, XU Cuiling, ZHANG Xiaodong, et al. Research progress in in-situ observations of dissolved methane seepage fluxed across the water-sediment interface [J]. Periodical of Ocean University of China, 2014, 44(12): 73-81.
[17] Leifer I, Boles J. Turbine tent measurements of marine hydrocarbon seeps on subhourly timescales [J]. Journal of Geophysical Research:Oceans, 2005, 110(C1): C01006.
[18] 邸鹏飞, 冯东, 高立宝, 等. 海底冷泉流体渗漏的原位观测技术及冷泉活动特征[J]. 地球物理学进展, 2008, 23(5):1592-1602 DI Pengfei, FENG Dong, GAO Libao, et al. In situ measurement of fluid flow and signatures of seep activity at marine seep sites [J]. Progress in Geophysics, 2008, 23(5): 1592-1602.
[19] 于新生, 李丽娜, 胡亚丽, 等. 海洋中溶解甲烷的原位检测技术研究进展[J]. 地球科学进展, 2011, 26(10):1030-1037 YU Xinsheng, LI Lina, HU Yali, et al. The development of in situ sensors for dissolved methane measurement in the sea [J]. Advances in Earth Science, 2011, 26(10): 1030-1037.
[20] Aleksanyan M S. Methane sensor based on SnO2/In2O3/TiO2 nanostructure [J]. Journal of Contemporary Physics (Armenian Academy of Sciences), 2010, 45(2): 77-80. doi: 10.3103/S1068337210020052
[21] Garcia M L, Masson M. Environmental and geologic application of solid-state methane sensors [J]. Environmental Geology, 2004, 46(8): 1059-1063. doi: 10.1007/s00254-004-1093-1
[22] Boulart C, Connelly D P, Mowlem M C. Sensors and technologies for in situ dissolved methane measurements and their evaluation using Technology Readiness Levels [J]. TrAC Trends in Analytical Chemistry, 2010, 29(2): 186-195. doi: 10.1016/j.trac.2009.12.001
[23] Camilli R, Duryea A N. Characterizing spatial and temporal variability of dissolved gases in aquatic environments with in situ mass spectrometry [J]. Environmental Science & Technology, 2009, 43(13): 5014-5021.
[24] Camilli R, Duryea A. Characterizing marine hydrocarbons with in-situ mass spectrometry[C]//Proceedings of the OCEANS 2007. Vancouver, Canada: IEEE, 2007: 1-7.
[25] Camilli R, Hemond H F. NEREUS/Kemonaut, a mobile autonomous underwater mass spectrometer [J]. TrAC Trends in Analytical Chemistry, 2004, 23(4): 307-313. doi: 10.1016/S0165-9936(04)00408-X
[26] Bell R J, Savidge W B, Toler S K, et al. In situ determination of porewater gases by underwater flow-through membrane inlet mass spectrometry [J]. Limnology and Oceanography:Methods, 2012, 10(3): 117-128.
[27] Brewer P G, Malby G, Pasteris J D, et al. Development of a laser Raman spectrometer for deep-ocean science [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2004, 51(5): 739-753. doi: 10.1016/j.dsr.2003.11.005
[28] Du Z F, Li Y, Chen J, et al. Feasibility investigation on deep ocean compact autonomous Raman spectrometer developed for in-situ detection of acid radical ions [J]. Chinese Journal of Oceanology and Limnology, 2015, 33(2): 545-550. doi: 10.1007/s00343-015-4096-8
[29] Thornton B, Takahashi T, Sato T, et al. Development of a deep-sea laser-induced breakdown spectrometer for in situ multi-element chemical analysis [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2015, 95: 20-36. doi: 10.1016/j.dsr.2014.10.006
[30] Zhang X, Du Z F, Luan Z D, et al. In situ Raman detection of gas hydrates exposed on the seafloor of the South China Sea [J]. Geochemistry, Geophysics, Geosystems, 2017, 18(10): 3700-3713. doi: 10.1002/2017GC006987
[31] Chou I M, Wang A L. Application of laser Raman micro-analyses to Earth and planetary materials [J]. Journal of Asian Earth Sciences, 2017, 145: 309-333. doi: 10.1016/j.jseaes.2017.06.032
[32] Long D A. Raman Spectroscopy[M]. Maidenhead: McGraw-Hill, 1977.
[33] McMillan P F, Hofmeister A M. Chapter 4. Infrared and Raman spectroscopy[M]//Hawthorne F C. Spectroscopic Methods in Mineralogy and Geology. Washington: Mineralogical Society of America, 1988: 99-160.
[34] Rull F. The Raman effect and the vibrational dynamics of molecules and crystalline solids[M]//Dubessy J, Caumon M C, Rull F. Raman Spectroscopy Applied to Earth Sciences and Cultural Heritage. EMU, 2012, 12: 1-60.
[35] Schmidt C, Seward T M. Raman spectroscopic quantification of sulfur species in aqueous fluids: ratios of relative molar scattering factors of Raman bands of H2S, HS-, SO2, HSO4-, SO42-, S2O32-, S3- and H2O at ambient conditions and information on changes with pressure and temperature [J]. Chemical Geology, 2017, 467: 64-75. doi: 10.1016/j.chemgeo.2017.07.022
[36] Qiu Y, Wang X L, Liu X, et al. In situ Raman spectroscopic quantification of CH4-CO2 mixture: application to fluid inclusions hosted in quartz veins from the Longmaxi Formation shales in Sichuan Basin, southwestern China [J]. Petroleum Science, 2020, 17(1): 23-35. doi: 10.1007/s12182-019-00395-z
[37] Zhang X, Walz P M, Kirkwood W J, et al. Development and deployment of a deep-sea Raman probe for measurement of pore water geochemistry [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2010, 57(2): 297-306. doi: 10.1016/j.dsr.2009.11.004
[38] Zhang X, Du Z F, Zheng R E, et al. Development of a new deep-sea hybrid Raman insertion probe and its application to the geochemistry of hydrothermal vent and cold seep fluids [J]. Deep Sea Research Part I:Oceanographic Research Papers, 2017, 123: 1-12. doi: 10.1016/j.dsr.2017.02.005
[39] Zhang X, Hester K C, Ussler W, et al. In situ Raman-based measurements of high dissolved methane concentrations in hydrate-rich ocean sediments [J]. Geophysical Research Letters, 2011, 38(8): L08605.
[40] Du Z F, Zhang X, Luan Z D, et al. In situ Raman quantitative detection of the cold seep vents and fluids in the chemosynthetic communities in the South China Sea [J]. Geochemistry, Geophysics, Geosystems, 2018, 19(7): 2049-2061. doi: 10.1029/2018GC007496
[41] Nikolovska A, Sahling H, Bohrmann G. Hydroacoustic methodology for detection, localization, and quantification of gas bubbles rising from the seafloor at gas seeps from the eastern Black Sea [J]. Geochemistry, Geophysics, Geosystems, 2008, 9(10): Q10010.
[42] Weber T C, De Robertis A, Greenaway S F, et al. Estimating oil concentration and flow rate with calibrated vessel-mounted acoustic echo sounders [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(50): 20240-20245. doi: 10.1073/pnas.1108771108
[43] Weber T C, Mayer L, Jerram K, et al. Acoustic estimates of methane gas flux from the seabed in a 6000 km2 region in the Northern Gulf of Mexico [J]. Geochemistry, Geophysics, Geosystems, 2014, 15(5): 1911-1925. doi: 10.1002/2014GC005271
[44] Loranger S, Bassett C, Cole J P, et al. Acoustically relevant properties of four crude oils at oceanographic temperatures and pressures [J]. The Journal of the Acoustical Society of America, 2018, 144(5): 2926-2936. doi: 10.1121/1.5078606
[45] Medwin H, Breitz N D. Ambient and transient bubble spectral densities in quiescent seas and under spilling breakers [J]. Journal of Geophysical Research:Oceans, 1989, 94(C9): 12751-12759. doi: 10.1029/JC094iC09p12751
[46] Vagle S, Farmer D M. The measurement of bubble-size distributions by acoustical backscatter [J]. Journal of Atmospheric and Oceanic Technology, 1992, 9(5): 630-644. doi: 10.1175/1520-0426(1992)009<0630:TMOBSD>2.0.CO;2
[47] Greinert J, McGinnis D F, Naudts L, et al. Atmospheric methane flux from bubbling seeps: spatially extrapolated quantification from a Black Sea shelf area [J]. Journal of Geophysical Research:Oceans, 2010, 115(C1): C01002.
[48] Römer M, Sahling H, Pape T, et al. Geological control and magnitude of methane ebullition from a high-flux seep area in the Black Sea-the Kerch seep area [J]. Marine Geology, 2012, 319-322: 57-74. doi: 10.1016/j.margeo.2012.07.005
[49] Römer M, Sahling H, Pape T, et al. Quantification of gas bubble emissions from submarine hydrocarbon seeps at the Makran continental margin (offshore Pakistan) [J]. Journal of Geophysical Research: Oceans, 2012, 117(C10): C10015.
[50] Wang B B, Socolofsky S A, Breier J A, et al. Observations of bubbles in natural seep flares at MC 118 and GC 600 using in situ quantitative imaging [J]. Journal of Geophysical Research:Oceans, 2016, 121(4): 2203-2230. doi: 10.1002/2015JC011452
[51] Hornafius J S, Quigley D, Luyendyk B P. The world's most spectacular marine hydrocarbon seeps (Coal Oil Point, Santa Barbara Channel, California): quantification of emissions [J]. Journal of Geophysical Research:Oceans, 1999, 104(C9): 20703-20711. doi: 10.1029/1999JC900148
[52] Quigley D C, Hornafius J S, Luyendyk B P, et al. Decrease in natural marine hydrocarbon seepage near Coal Oil Point, California, associated with offshore oil production [J]. Geology, 1999, 27(11): 1047-1050. doi: 10.1130/0091-7613(1999)027<1047:DINMHS>2.3.CO;2
[53] Padilla A M, Loranger S, Kinnaman F S, et al. Modern assessment of natural hydrocarbon gas flux at the coal oil point seep field, Santa Barbara, California [J]. Journal of Geophysical Research:Oceans, 2019, 124(4): 2472-2484. doi: 10.1029/2018JC014573
[54] Di P F, Chen Q H, Chen D F. Quantification of methane fluxes from hydrocarbon seeps to the ocean and atmosphere: development of an in situ and online gas flux measuring system [J]. Journal of Ocean University of China, 2017, 16(3): 447-454. doi: 10.1007/s11802-017-3061-x
[55] Di P F, Feng D, Chen D F. In-situ and on-line measurement of gas flux at a hydrocarbon seep from the northern South China Sea [J]. Continental Shelf Research, 2014, 81: 80-87. doi: 10.1016/j.csr.2014.04.001
[56] Johansen C, Todd A C, MacDonald I R. Time series video analysis of bubble release processes at natural hydrocarbon seeps in the Northern Gulf of Mexico [J]. Marine and Petroleum Geology, 2017, 82: 21-34. doi: 10.1016/j.marpetgeo.2017.01.014
[57] Di P F, Feng D, Tao J, et al. Using time-series videos to quantify methane bubbles flux from natural cold seeps in the South China Sea [J]. Minerals, 2020, 10(3): 216. doi: 10.3390/min10030216
[58] Kennicutt II M C, Brooks J M, Bidigare R R, et al. Gulf of Mexico hydrocarbon seep communities-I. Regional distribution of hydrocarbon seepage and associated fauna [J]. Deep Sea Research Part A. Oceanographic Research Papers, 1988, 35(9): 1639-1651. doi: 10.1016/0198-0149(88)90107-0
[59] Wankel S D, Joye S B, Samarkin V A, et al. New constraints on methane fluxes and rates of anaerobic methane oxidation in a Gulf of Mexico brine pool via in situ mass spectrometry [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2010, 57(21-23): 2022-2029. doi: 10.1016/j.dsr2.2010.05.009
[60] Lapham L L, Alperin M, Chanton J, et al. Upward advection rates and methane fluxes, oxidation, and sources at two Gulf of Mexico brine seeps [J]. Marine Chemistry, 2008, 112(1-2): 65-71. doi: 10.1016/j.marchem.2008.06.001
[61] Solomon E A, Kastner M, Jannasch H, et al. Dynamic fluid flow and chemical fluxes associated with a seafloor gas hydrate deposit on the northern Gulf of Mexico slope [J]. Earth and Planetary Science Letters, 2008, 270(1-2): 95-105. doi: 10.1016/j.jpgl.2008.03.024
[62] Martens C S, Mendlovitz H P, Seim H, et al. Sustained in situ measurements of dissolved oxygen, methane and water transport processes in the benthic boundary layer at MC118, northern Gulf of Mexico [J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2016, 129: 41-52. doi: 10.1016/j.dsr2.2015.11.012
[63] Johansen C, Macelloni L, Natter M, et al. Hydrocarbon migration pathway and methane budget for a Gulf of Mexico natural seep site: green Canyon 600 [J]. Earth and Planetary Science Letters, 2020, 545: 116411. doi: 10.1016/j.jpgl.2020.116411
[64] Lapham L, Wilson R, Riedel M, et al. Temporal variability of in situ methane concentrations in gas hydrate-bearing sediments near Bullseye Vent, Northern Cascadia Margin [J]. Geochemistry, Geophysics, Geosystems, 2013, 14(7): 2445-2459. doi: 10.1002/ggge.20167
[65] Thomsen L, Barnes C, Best M, et al. Ocean circulation promotes methane release from gas hydrate outcrops at the NEPTUNE Canada Barkley Canyon node [J]. Geophysical Research Letters, 2012, 39(16): L16605.
[66] Marcon Y, Römer M, Scherwath M, et al. Variability of marine methane bubble emissions on the Clayoquot slope, offshore Vancouver Island, between 2017 and 2021 [J]. Frontiers in Earth Science, 2022, 10: 864809. doi: 10.3389/feart.2022.864809
-
期刊类型引用(1)
1. 胡广,黄建宇,杨胜雄,李沅衡,田冬梅,曹荆亚,周军明,邓雨恬. 琼东南海域冷泉微地震响应特征初探——以“海马”冷泉为例. 海洋地质与第四纪地质. 2024(06): 12-24 .  本站查看
本站查看
其他类型引用(2)



 下载:
下载: